Уравнение изотермы адсорбции Ленгмюра
Типы адсорбционных взаимодействий
При адсорбции действуют в основном дисперсионные силы, которые вызываются согласованным движением электронов в сближающихся молекулах. Из-за этого даже молекулы с симметричным распределением электронной плотности испытывают колеблющиеся по направлению движения отклонения от этой плотности. При сближении молекул эти колебания теряют независимость, что и вызывает притяжение. Часто имеют значение электростатические силы: ориентационные силы при адсорбции полярных молекул на поверхностях с постоянными электростатическими зарядами и индукционные, обусловленные появлением в адсорбирующихся молекулах дипольных моментов, наведенных зарядами поверхности, или появлением дипольных моментов в адсорбенте, наведенных адсорбирующимися диполями. Перечисленные силы являются силами притяжения. При сближении молекул адсорбата и адсорбента они уравновешиваются силами отталкивания, которые быстро растут на коротких расстояниях.
Адсорбирующаяся молекула взаимодействует со многими центрами на поверхности адсорбента. На практике при расчетах учитывается взаимодействие с 100–200 ближайшими атомами адсорбента.
Во многих случаях энергия индукционного и ориентационного взаимодействия много больше энергии дисперсионного взаимодействия, поэтому часто принимается, что последняя определяет энергию межмолекулярного притяжения.
При адсорбции часто происходит образование водородной связи, например, в случае молекул воды, спиртов, эфиров, аминов на адсорбентах, поверхность которых покрыта гидроксильными группами (силикагель ).
Теория мономолекулярной адсорбции предложена Ленгмюром в 1915 году. При выводе уравнения учитывались следующие положения.
1. Адсорбция локализована и вызвана силами, близкими к химическим.
2. Адсорбция происходит на активных центрах на поверхности адсорбента (пики). Активные центры занимают незначительную часть поверхности.
3. Каждый активный центр адсорбирует только одну молекулу адсорбата, и на поверхности образуется его молекулярный слой.
4. Адсорбированные молекулы удерживаются активными центрами в течение определенного времени, которое зависит от температуры.
5. Силами взаимодействия между адсорбированными молекулами можно пренебречь.
Для вывода уравнения представим локализованную адсорбцию газа как квазихимическую реакцию между молекулами газа и активным центром адсорбента с образованием адсорбционного комплекса:
молекула газа + активный центр адсорбента ® адсорбционный комплекс.
В этом случае  , (2.4)
, (2.4)
где 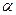 – поверхностная концентрация адсорбата,
– поверхностная концентрация адсорбата, 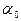 – концентрация свободных активных центров на поверхности адсорбента, P – давление газа, k – константа, не зависящая от концентрации, или давления и постоянная при данной температуре.
– концентрация свободных активных центров на поверхности адсорбента, P – давление газа, k – константа, не зависящая от концентрации, или давления и постоянная при данной температуре.
Поскольку каждый активный центр может занять одна молекула, то
 , (2.5)
, (2.5)
где :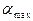 – поверхностная концентрация адсорбата при заполнении всех активных центров. Уравнение (2.5) запишем в виде
– поверхностная концентрация адсорбата при заполнении всех активных центров. Уравнение (2.5) запишем в виде
 (2.6)
(2.6)
и подставим в (2.4):
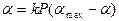 . (2.7)
. (2.7)
Решив его относительно 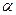 , получим
, получим
 . (2.8)
. (2.8)
Это уравнение адсорбции Ленгмюра. Его иногда записывают в виде
 .
.
Поскольку a пропорционально 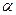 , то
, то  , (2.9)
, (2.9)
где  – количество адсорбата в молях, адсорбированное 1 граммом адсорбента при полном заполнении активных центров.
– количество адсорбата в молях, адсорбированное 1 граммом адсорбента при полном заполнении активных центров.
Уравнение Ленгмюра пригодно для описания адсорбции газов и растворенных веществ.
Чтобы получить выражение, пригодное для графического решения, делят давление р на обе части уравнения:
 . (2.10)
. (2.10)
Это уравнение прямой в координатах р/a – р (рис. 2.2). Оно хорошо описывает адсорбцию, обусловленную силами, близкими по своей природе к химическим.

Рис. 2.2. Графическое решение уравнения Ленгмюра
В некоторых случаях наблюдается ступенчатая адсорбция, когда изотерма состоит из ряда ступеней. По теории Ленгмюра это обусловлено тем, что на поверхности адсорбента существуют группы активных центров с резко различной активностью.