Второй закон термодинамики. Энтропия
Второй закон определяет, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрациях могут протекать самопроизвольно,то есть без затраты работы извне; каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов.
Несамопроизвольные процессы не могут осуществляться без воздействия извне, само воздействие извне может быть в виде передачи системе энергии из окружающей среды (переход тепла от холодного тела к горячему - процессы в холодильнике).
В отличие от первого закона термодинамики, второй закон обладает более ограниченной областью применения, он носит статистическийхарактер, то есть, применим к системам из большого числа частиц, поведение которых может быть выражено законами статики.
Чем больше тепла выделяется при экзотермических реакциях, тем большим сродством друг к другу обладают реагирующие вещества, тем прочнее связи в полученных продуктах. В обратном направлении процесс может пойти лишь при сообщении системе тепла извне.
Для любой термодинамической системы при данных условиях её существования всегда имеется некоторый общий критерий, которым характеризуется возможность, направление и предел самопроизвольного протекания процессов. Для изолированных систем критерием является энтропия (S).Термин был введен Рудольф Клаузиусом (1822-1888).
Любая система стремится к уменьшению величины ∆H и увеличению величины ∆S. Второй закон термодинамики устанавливает, чтов изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Изменение энтропии в процессе зависит от начального и конечного состояний и не зависит от пути перехода
∆Sх.р.= ∑Sпрод. - ∑Sисх.в-в.
Энтропия- термодинамическая функция, которая характеризует меру упорядоченности системы или меру беспорядка.
Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру 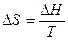 Например, при 0°С, то есть при 273 К, теплота плавления льда ∆Hпл = 5993,7 Дж/моль; возрастание энтропии при плавлении льда при этой температуре
Например, при 0°С, то есть при 273 К, теплота плавления льда ∆Hпл = 5993,7 Дж/моль; возрастание энтропии при плавлении льда при этой температуре 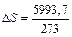 = 21,95 Дж/моль-К. Энтропию относят к 1 молю вещества в стандартных условиях S°298 ; известно абсолютное значение энтропии для веществ; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль∙К = 1 э.е.
= 21,95 Дж/моль-К. Энтропию относят к 1 молю вещества в стандартных условиях S°298 ; известно абсолютное значение энтропии для веществ; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль∙К = 1 э.е.
Отсюда следует, что в любых изолированных системах(а в них могут совершаться только адиабатные процессы) энтропия системы сохраняет постоянное значение. Следовательно, в изолированных системахвсякий самопроизвольно протекающий процесс сопровождается возрастанием энтропии. В случае закрытых систем энтропия в ходе процесса может, как увеличиваться, так и уменьшаться. Процессы для которых: 1) ∆S > 0 - расширение газов, фазовые превращения из твердого к жидкому и газообразному состоянию, растворение кристаллических веществ; 2) ∆S < 0 – сжатие газов, конденсация и кристаллизация веществ.
Установление статистической природы второго закона дало возможность Л. Больцману в 1896 г. определить статистический смысл энтропии
S = kБ.lnW,
где kБ - постоянная Больцмана - kБ = R/NA; W- термодинамическая вероятность данного состояния системы. Термодинамическая вероятность - это число микросостояний, через которые может быть реализовано данное микросостояние. Энтропия является мерой вероятности состояния системы.
Статистическая термодинамика показывает, что энтропия может рассматриваться как сумма составляющих, относящихся к различным формам движения частиц. Различают следующие составляющие энтропии: энтропия поступательного движения молекул Sпост.; энтропия вращательного движения молекул Sвращ. ; энтропия вращательного движения атомов и атомных групп, содержащихся в молекуле, Sвн.вращ. (энтропия внутреннего вращения); энтропия колебательного движения атомов и атомных групп, содержащихся в молекуле,Sкол;; и энтропия движения электронов Sэл
S = Sпост + Sвращ + Sвн.вращ + Sкол + Sэл
Энтропия зависит от всех видов движения частиц, содержащихся в молекуле, и возрастает при всех процессах, вызываемых движением частиц: испарение, плавление, растворение, диффузия, расширение газа; возрастает при ослаблении связей между атомами в молекулах и при разрыве связей, то есть при диссоциации молекул. Наоборот, при упрочнении связей энтропия уменьшается, то есть при кристаллизации, конденсации, сжижении газов.
Энтропия увеличивается с повышением температуры и уменьшается с повышением давления. В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул, а также по мере усложнения состава молекул.
| Вещество | Sо298, Дж/моль∙К | Вещество | Sо298, Дж/моль∙К |
| HF | 173,5 | CuO | 43,5 |
| HCl | 186,4 | Cu2O | 100,7 |
| HBr | 198,1 | CO | 197,7 |
| CO2 | 213,6 |
Чем больше твердость вещества, тем меньше его энтропия. Например: графит - Sо298 = 5,74 Дж/моль∙К, алмаз - Sо298 = 2,37 Дж/моль∙К. Энтропия в аморфном и стеклообразном состоянии больше, чем в кристаллическом. Энтропия возрастает с увеличением дисперсности частиц вещества.