Закон Гесса. Следствия из него
Уравнения химических реакций, в которых указаны их тепловые эффекты и агрегатные состояния компонентов называются термохимическими.От агрегатных состояний веществ зависит состояние системы в целом и в термохимических уравнениях с помощью буквенных индексов (тв.), (кр.), (ж.), (г.) обозначается твердое, кристаллическое, жидкое, газообразное состояние веществ.
В термохимических уравнениях допускаются дробные коэффициенты, так как тепловой эффект рассчитывается на 1 моль образовавшегося вещества. Например, для химической реакции
Н2 + Сl2 = 2НСl
термохимическое уравнение записывается так
1/2Н2(г) + 1/2Сl2(г) = НСl(г) + 92,3 кДж или
1/2Н2(г) + 1/2Сl2(г) = НСl(г); ∆Н = - 92,3 кДж.
Данный процесс экзотермичен, так как количество энергии, выделившейся при образовании связи H–Cl превышает расход энергии, затрачиваемый на разрыв связей
Н-Н и Cl-Cl.
Сравнение тепловых эффектов различных процессов проводят при одинаковых, стандартных условиях:температуре 298 К (25 °С) и давлении Р = 101 325 Па
= 760 мм. рт. ст. = 1 атм. Определенные для веществ в стандартном состоянии стандартные энтальпии и другие стандартные термодинамические величины обозначают верхним индексом (°), нижним индексом указывают температуру, при которой они определены: ∆Hо298, ∆Uо298 (определены при 298 К) или ∆Но1000, ∆U°1000 (определены при 1000 К). Такое единообразие делает расчёты строгими.
Стандартная энтальпия образования вещества ∆Но298 - это изменение энтальпии в процессе образования данного вещества в стандартном состоянии из термодинамически устойчивых форм простых веществ, также находящихся в стандартных состояниях.
Для многих веществ стандартные энтальпии образования известны и сведены в таблицы. Стандартные значения энтальпии простых веществ, если их модификации устойчивы при стандартных условиях, равны нулю. Например, ∆Hо298 (H2(г)) = 0 .
Если стандартная энтальпия образования отрицательна, соединение более устойчиво, чем простые вещества, из которых оно образовалось и наоборот. В ряду однотипных соединений, чем меньше стандартная энтальпия образования соединения (∆Hо298), тем больше его термическая устойчивость относительно разложения на простые вещества. Например, в ряду ZnO → CdO → HgO более устойчивым является ZnO, так как ∆Hо298(ZnO) = -350,6 кДж/моль, ∆Hо298(CdO) = -260,0 кДж/моль, ∆Hо298(HgO) = +99,9 кДж/моль или в ряду NH3 → PH3 → AsH3 → SbH3 (∆Hо298(NH3) = -46,15 кДж/моль, ∆Hо298(PH3) = +12,96 кДж/моль, ∆Hо298(AsH3) = +66,38 кДж/моль, ∆Hо298(SbH3) = +145,00 кДж/моль) газообразный NH3 является устойчивым соединением, PH3 и AsH3 – неустойчивы (нестабильны), SbH3 – разлагается в момент получения.
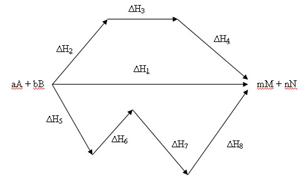
Обобщение экспериментальных исследований по тепловым эффектам химических реакций привело русского ученого Г. И. Гесса к открытию закона в 1840 г., носящего его имя (закон Гесса). Это второй закон термохимии: "Тепловой эффект процесса зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода".То есть если из данных исходных веществ можно различными способами получить заданные конечные продукты, то независимо от путей получения суммарный тепловой эффект будет одним и тем же.
|
аА + вВ = mM + nN
Продукты реакции М и N могут быть получены различными путями: 1) непосредственно реакцией, тепловой эффект которой равен ∆Н1; 2) реакциями, тепловые эффекты которых равны соответственно ∆Н2, , ∆Н3, и ∆Н4; 3) рядом реакций с тепловыми эффектами ∆Н5 , ∆Н6 , ∆Н7 и ∆Н8. Эти тепловые эффекты, согласно закону Гесса, связаны между собой соотношением ∆Н1 = ∆Н2 + ∆Н3 + ∆Н4 = ∆Н5 + ∆Н6 + ∆Н7 + ∆Н8 .
Закон Гесса широко применяется при различных термохимических расчетах; дает возможность вычислить тепловые эффекты процессов с отсутствующими экспериментальными данными или в процессах, для которых тепловые эффекты не могут быть измерены, или если процессы еще не осуществились. Если известны энтальпии образования всех веществ, участвующих в реакции, то можно рассчитать тепловой эффект любой реакции.
Так, образование СО2 из простых веществ может происходить двумя путями. Прямой путь – непосредственное сгорание графита до СО2
С(графит) + О2(г) → СО2(г); ∆Н1о = -393,5 кДж.
Косвенный путь – суммарный процесс образования и окисления СО
С(графит) + ½ О2(г) → СО(г); ∆Н2о = -110,5 кДж.
СО(г) + ½ О2(г) → СО2(г); ∆Н3о = -283,0 кДж.
С(графит) + О2(г) → СО2(г)
Рассмотренные превращения отражает схема
начальное состояние С(графит) + О2(г) -------→ СО2(г) конечное состояние
При сложение ∆Н2о + ∆Н3о = -110,5 + (-283,0) = -393,5 кДж, что соответствует значению ∆Н3о = -393,5 кДж.
Из закона Гесса, который является одним из следствий закона сохранения энергии, вытекает ряд выводов. Наиболее важны из них два:
1) тепловой эффект химической реакции при р = соnst равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом коэффициентов перед формулами веществ в уравнении; то есть для реакции
aA + bB = mM + nN
∆Hох.р. = (m∆Нообр. М + n∆Hoобр. N) – (a∆Hoобр.А + b∆Hoобр. В)
2) тепловой эффект реакции горения равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов:
∆Hох.р. = (a∆Нообр.A + b∆Hoобр. B) – (m∆Hoобр.M + n∆Hoобр. N)
Первое следствие имеет общее значение, второе важно для органических соединений. Первый закон термодинамики имеет универсальный характер, он применим и для одной молекулы, и для большого числа молекул; но он не указывает на характер, возможности и направление процессов, при которых могут или будут происходить превращения энергии.