Основные понятия
Элементы химической термодинамики
Строение и функции АТФ
Аденозинтрифосфорная кислота (АТФ) — универсальный источник и основной аккумулятор энергии в живых клетках. АТФ содержится во всех клетках растений и животных. Количество АТФ в среднем составляет 0,04% (от сырой массы клетки), наибольшее количество АТФ (0,2–0,5%) содержится в скелетных мышцах.
АТФ состоит из остатков: 1) азотистого основания (аденина), 2) моносахарида (рибозы), 3) трех фосфорных кислот. Поскольку АТФ содержит не один, а три остатка фосфорной кислоты, она относится к рибонуклеозидтрифосфатам.
Для большинства видов работ, происходящих в клетках, используется энергия гидролиза АТФ. При этом при отщеплении концевого остатка фосфорной кислоты АТФ переходит в АДФ (аденозиндифосфорную кислоту), при отщеплении второго остатка фосфорной кислоты — в АМФ (аденозинмонофосфорную кислоту). Выход свободной энергии при отщеплении как концевого, так и второго остатков фосфорной кислоты составляет по 30,6 кДж. Отщепление третьей фосфатной группы сопровождается выделением только 13,8 кДж. Связи между концевым и вторым, вторым и первым остатками фосфорной кислоты называются макроэргическими (высокоэнергетическими).
Запасы АТФ постоянно пополняются. В клетках всех организмов синтез АТФ происходит в процессе фосфорилирования, т.е. присоединения фосфорной кислоты к АДФ. Фосфорилирование происходит с разной интенсивностью при дыхании (митохондрии), гликолизе (цитоплазма), фотосинтезе (хлоропласты).
АТФ является основным связующим звеном между процессами, сопровождающимися выделением и накоплением энергии, и процессами, протекающими с затратами энергии. Кроме этого, АТФ наряду с другими рибонуклеозидтрифосфатами (ГТФ, ЦТФ, УТФ) является субстратом для синтеза РНК.
Термодинамика (от греч. Theme – тепло + Dinamis – сила) - наука о превращениях различных видов энергии при взаимодействиях между объектами, которые ограничиваются тепловым обменом и работой. Она исторически возникла как эмпирическая наука об основных способах преобразования внутренней энергии тел для совершения механической работы. Однако в процессе своего развития термодинамика позволила теоретически предсказать многие явления задолго до появления теории, описывающей эти явления. Изучением химических и физико-химических процессов занимается часть термодинамики, называемая химической термодинамикой.
Химическая термодинамикарассматривает явления, относящиеся к области химии: изучает зависимость свойств веществ от их химического состава и строения, от условий существования данного вещества. Она базируется на двух основных законах, называемых первым (закон А. Лавуазье и П. Лапласа и вторым законами (закон Герман (Генрих) Ивановича Гесса ) термодинамики. В химической термодинамике рассматриваются только системы, в которых отсутствуют направленные потоки теплоты, концентрации, давления – системы, находящиеся в термодинамическом равновесии. Для удобства изучения необходимо изолировать объекты исследования от окружающего пространства и поэтому образующийся объект термодинамического изучения называется системой. Система - это тело или группа тел, или совокупность веществ, находящихся во взаимодействии и обособленных от окружающей их внешней среды.Внешняя среда - это все, что окружает систему. Между системой и внешней средой существует истинная или условная граница раздела.
Различают системы гомогенные,внутри которых нет поверхностей раздела,отделяющих друг от друга части системы, различающиеся по свойствам, и гетерогенные- имеющие поверхности раздела.
Фаза- это совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам, не зависящим от количества вещества и ограниченных от других частей системы некоторой поверхностью раздела. Однако, не всегда фаза имеет на всем протяжении одинаковые физические свойства и однородный химический состав. Фаза может быть прерывна, например, кусочки льда, плавающие на поверхности воды.
Вещества, входящие в состав фаз, называются компонентами,или составными частями системы, они могут быть выделены из системы и существовать вне её.
Системы могут по-разному взаимодействовать с внешней средой. Открытаясистема обменивается с внешней средой и энергией, и веществом. Закрытаясистема обменивается с внешней средой только энергией. Изолированнойсистемой называют такую, которая лишена возможности обмена веществом или энергией с окружающей средой и которая имеет постоянный объём (изменение объема всегда связано с производством работы).
В каждый момент времени состояние системы характеризуется термодинамическими параметрами состояния,то есть какими-то физическими свойства. Термодинамические параметры: температура, давление объём и концентрация. Совокупность термодинамических параметров определяет термодинамическое состояние системы. Изменение термодинамического состояния системы называется термодинамическим процессом.
Термодинамический процесс- это всякое изменение состояния системы, связанное с изменением хотя бы одного параметра. Совокупность промежуточных состояний, через которые проходит система, называют путем процесса.Различают пути процесса:
1. Изобарный (Р = const);
2. Изохорный (V = соnst);
3. Изотермический (Т = соnst);
4. Изобарно-изотермический (Р и Т = соnst);
5. Изохорно-изотермический (V и Т = соnst);
6. Адиабатный, в котором отсутствует обмен теплотой между системой и внешней средой, но может быть связь работой.
Каждую систему можно описать с помощью уравнений состояния,которыми являются:
1) закон Бойля-Мариотта: Р1V1 = Р2V2;
2) закон Шарля: V1Т2 = V2T1;
3) закон Гей-Люссака: Р1Т2 = Р2Т1;
4) уравнение Менделеева-Клапейрона: РV = mRT/M;
5) объединенное уравнение газового состояния: 
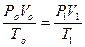 .
.