Потери цианида
Электрохимическая природа цианирования
Экспериментами установлено, что цианирование - типичный электрохимический процесс. На анодных участках протекают реакции :
A : Au + 2CN- = [Au(CN)2]- + e
K : O2+ 2H2O+2e = 2OH- + H2O2
Из электрохимической природы цианирования можно сделать вывод, что если Au ассоциировано с сульфидными минералами, которые могут выполнять роль катодных участков, то скорость растворения золота увеличивается.
Расход цианида - одна из основных статей в себестоимости переработки Au руды. Теоретически, для растворения 1г Au достаточно 0.49г NaCN. На практике расход в десятки раз больше(до 6 кг.). Это связано с потерями цианида.
Различают потери :
1. Механические потери - связаны с разливом раствора, потери при открытии бочек с NaCN (они невелики) ;
2. Потери не отмытого NaCN (потери с хвостами цианирования). Для их снижения необходима тщательная отмывка обеззолоченых хвостов от золотосодержащих цианистых pастворов.
3. Потери за счет гидролиза

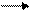
 NaCN + H2O NaOH + HCN
NaCN + H2O NaOH + HCN
сильный яд
1г Au – 0,49г NaCN
Для снижения протекания данной реакции в раствор вводят защитную щелочь(CaO, Ca(OH)2) или NaOH - сдвиг равновесия реакции влево). Без защитной щелочи стадия гидролиза 3-16%. Использование защитной щелочи снижает до 0.1-0.3%.
Концентрация защитной щелочи: CCaO = 0.001 0.02%.
Чаще применяют CaO как более дешевую, кроме того CaO выполняет роль коагулянта.
4. Потери цианида за счет химического взаимодействия с минералами
Руда содержит инертную породу: SiO2, Al2O3, MgO, оксиды Fe(III, II), и содержит оксиды, сульфиды, арсениды ЦМ и Fe, которые активно взаимодействуют с цианидом.
Соединения Fe :
Присутствуют в виде : Fe2O3, Fe3O4, FeOOH, FeCO3, FeS2,
FeS и другие. Окисленные соединения Fe2O3, Fe3O4,
FeOOH, FeCO3 не взаимодействуют с NaCN. Поведение сульфидов зависит от их структуры и типа. Их различают: плотные и рыхлые, пористые.
Пирит- разрушается медленно и не оказывает влияние на потери цианида.
Влияние маркизита и FeS на потери цианида велико: pасход NaCN увеличивается, скорость растворения и извлечение золота – уменьшается.
FeS u FeS2 (марказит) начинают разлагаться уже в водных средах (при измельчении, сгущении, цианировании).
При измельчении :
2FeS2+7O2+2H2O = 2Fe2++4SO42-+4H+;
2FeS+O2+4H+ = 2Fe+2+2S+2H2O.
Fe2+ + 5H2O+SO42- = 2Fe2O3*SO3 +10H+
не взаимодействует
2Fe2O3*SO3 + 7H2O = 4Fe(OH)3 + 2H+ +SO42-
не взаимодействует
S+CN- = SCN-
2S + 2OH- +O2 = S2O52- + H2O
При цианировании :
H+ + CN- = HCN
Fe2+ + 2H- = Fe(OH)2
Fe(OH)2 + 2CN- = Fe(CN)2 +2OH-
цианистое Fe
Fe(СN)2 + 4CN- = [Fe(CN)6]4-
железистая соль
При недостатке защитной щелочи:
2Na+ + Fe 2+ + [Fe(CN)6]4- = Na2Fe[Fe(CN)6]
голубовато- белый осадок
Na2Fe[Fe(CN)6]+O2+2H2O = Fe4[Fe(CN)6]3 +[Fe(CN)6]4- + 4OH- +8H+
синий цвет - это нарушение технологического процесса.
Вывод: при появлении синей окраски раствора необходимо ввести защитную щелочь.
В процессе цианирования сульфиды железа непосредственно взаимодействуют с цианистыми растворами.
4FeS+3O2+4CN-+6H2O = 4Fe(OH)3+4CN5 ;
FeS + 6CN- = [Fe(CN)6]4-+S2- и т.д.
Продуктами взаимодействия являются цианистые соединения: Fe2+, Fe3+, S2-, CN5, S2O32-, SO42- и т.д.
CN5, S2O32-, SO42-- относительно безвредные.
S2- -оказывает вредное влияние на последующие операционные осаждения Au . Zn - поглощается.
Fe 2+, Fe 3+ - большой расход CN, снижается извлечение Au.
Поэтому, если в руде много сульфидов железа необходимо принимать соответствующие меры :
 1. Предварительным перемешиванием агрегация пульпы в щелочном растворе: Fe2+ Fe3+.
1. Предварительным перемешиванием агрегация пульпы в щелочном растворе: Fe2+ Fe3+.
 2. Интенсивная аэрация пульп в процессе цианирования : Fe2+ Fe3+.
2. Интенсивная аэрация пульп в процессе цианирования : Fe2+ Fe3+.
Введение в пульпу солей свинца. Введенный свинец связывает сульфидную серу в безвредные роданиды. Тем самым повышается извлечение золота.
Минералы Cu
Cu существует в виде различных сульфидных и окислительных минералов : CuFeS2, Cu2S, Cu3FeS2, 2Cu(OH)2, CuCO3*Cu(OH)2, Cu2S*As2S3 , Cu2S*Sb2S3, CuSiO3, … Cu(очень редко). Все они, кроме CuFeS2 и CuSiO3 активно взаимодействуют с цианистыми растворами по реакциям :
2Cu+6NaCN+2H2O = Na4[Cu(CN)6]+2NaOH+H2 ;
Cu2+SO4+2NaCN = Cu1+CN + Na2SO4+1/2(CN)2;
CuCN+2NaCN = Na2[Cu+(CN)3];
Cu2+(OH)2+4NaCN = Na2[Cu1+(CN)3]+2NaOH+1/2(CN)2
CuCO3+4NaCN = Na2[Cu(CN)3]+2Na2CO3+1/2(CN)2
(CN)2 + 2OH- = CN- + CNO- + H2O
цианат-ион
2Cu2S+6NaCN+H2O+1/2O2 = 2CuS+2Na2[Cu(CN)3]+2NaOH
2CuS+6NaCN+H2O+1/2O2 = 2Na2[Cu(CN)3]+ 2NaOH+2S
вредно!
S + CN- = SCN-
роданид-ион- безвредный
Таким образом расходуется большое количество NaCN,
часть растворенного O2 и образуются сложные комплексные ионы меди. Все это приводит к снижению концентрации NaCN в растворе, снижению концентрации растворенного O2 , а значит к снижению скорости растворения Au , извлечения Au из раствора.
Поэтому даже присутствие в руде сотых долей % меди приводит к нарушению технологического процесса цианирования. Считают, что причиной этого является:
1. Снижение концентрации NaCN и O2 в растворе ;
2. Образование на поверхности Au - частицы в присутствии растворенных комплексов Cu плотных пленок вторичного происхождения.
Например, пленка может образоваться по следующей pеакции:
8[Cu(CN)2]-+4Au+2H2O+O2 = 8CuCN+4[Au(CN)2]+4OH-
нерастворимое соединение
Если в руде присутствуют даже сотые доли % меди, перед цианированием ее необходимо удалить из руды следующими методами :
1. Флотация (Если Сu в виде сульфидов);
2. Выщелачивание перед цианированием соединений Cu кислыми или аммиачными растворами с последующим цианированием руды (если Cu в виде окисленных форм) ;
4. Метод Мостовича.
Метод заключается в выщелачивании меди в серно- кислом растворе, цементации Cu из кислого раствора и далее без фильтрации флотация Cu и сульфидов Cu. Остаток после промывки отправляется на цианирование .Или при CCu вести цианирование слабыми растворами CCN-=0.005%.
Соединения As и Sb
Являются чрезвычайно вредными для цианистого процесса. Основное вредное их влияние связано с образованием на их поверхности Au нерастворимых пленок. Кроме того, на свое растворение они расходуют О2 , цианид, защищенную щелочь.
Все это приводит к резкому уменьшению извлечения Au (30-40%).
В рудах As и Sb находятся в основном в виде сульфидных соединений, но может быть и окисленные соединения:
FeAsS, As2S3, As2S4, Sb2S3, Sb2O3, Sb2O4 и т.д.
В щелочной цианистой среде эти соединения разлагаются:
Sb2S3+6OH- = SbO33-+SbS33-+3H2O
окси-ион тио-ион
2SbS33-+12OH-=2SbO33-+6S2+6H2O
2SbS33-+ 6CN- + 3O2 = 6CNS-+2SbO33-
Sb2S3 + 3S2- = 2SbS33- и т.д.
Присутствие растворенных соединений Sb сказывается на образовании пленок на Au. Мышьяковистые и сурьмянистые руды считаются упорными. При невысоком содержании As и Sb можно вести цианирование при следующих условиях :
1. Снижение COH- (защитной щелочи):
COH- = 0.001-0.03%.
2. Вводят в раствор растворимые соли Pb : Pb(NO3)2 или уксусно - кислый Pb. Соединения Pb связывают сульфидную S в безвредный роданид- ион CN5. Химизм этого процесса описывается следующими реакциями:
return false">ссылка скрытаPbO+2OH- = PbO22-+H2O ;
PbO22-+S2-+2H2O = PbS + 4OH- ;
3PbO22- + 2SbS33- + 6H2O = 3PbS+Sb2S3+12OH- ;
3PbO22- + 2SbS33- + 6H2O = 3PbS+Sb2S3+12OH-
PbS+CN- +1/2O2+2OH- = CNS-+PbO22-+ H2O и т.д.
При высоком содержании As и Sb необходима флотация или другие специальные методы переработки.
Соединения Zn
Zn присутствует в окислительной или сульфидной форме. Сульфиды слабо взаимодействуют с цианистыми растворами:
ZnS+4CN- = [Zn(CN)4]2- + S2-;
2ZnS +10CN-+O2+2H2O = 2[Zn(CN)4]2- + CNS+4OH-.
Окисленные соединения Zn растворяются полностью и быстрее, чем Au :
ZnO+2CN-+H2O = [Zn(CN)4]2- + 2OH-;
Металлический цинк :
Zn+4CN-+2H2O=[Zn(CN)4]2-+2OH-+H2
Существенного влияния на процесс соединения Zn не оказываeт.
Cоединения Pb
B небольших колличествах являются полезными.
Соединения Hg.
Hg может попадать в руду после амальгамации . Растворяется медленно, относительно безвредна.
’’ Утомляемость’’ растворов
Технологически ’’утомляемость’’ проявляется понижением извлечения Au. Происходит оно по мере накопления в оборотном цианистом растворе примесей ЦМ и железа. При повышенной концентрации примесей в растворе возможно образование пленок на Au. При ’’утомляемости’’ необходим срочный вывод частиoindex>