Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса.
| 1. | Запишите схему реакции (формулы исходных веществ и продуктов реакции). | NH3+CuO→N2+Cu+H2O |
| 2. | Определите и сравните степени окисления элементов до и после реакции. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O |
| 3. | Выбрать (подчеркнуть) элементы, степени, окисления которых изменяются. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O |
| 4. | Выписать эти элементы (простые вещества выписываются с индексами). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O N-3 →N20 Cu+2 →Cu0 |
| 5. | Определить сколько отдал или принял элемент электронов (помнить, что электроны заряжены отрицательно). Количество электронов с участием простых веществ умножается на индекс, а перед ионом выставляется коэффициент, равный индексу. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 Cu+2 +2℮ →Cu0 |
| 6. | Определите окислитель и восстановитель (окислитель всегда принимает электроны – степень окисления понижается, восстановитель их отдает – степень окисления повышается). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 восстановитель Cu+2 +2℮ →Cu0 окислитель |
| 7. | Выписать то количество электронов, которое определили. Найти для этих чисел наименьшее кратное. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 – 6℮ →N20 6 восстановитель 6 Cu+2 +2℮ →Cu0 2 окислитель |
| 8. | Определить коэффициенты (разделив поочередно наименьшее кратное на количество электронов). | -3+1 +2-2 0 0 +1-2
NH3+CuO→N2+Cu+H2O
2N-3 - 6℮ →N20 6 1  восстановитель 6
Cu+2 +2℮ →Cu0 2 3
окислитель
восстановитель 6
Cu+2 +2℮ →Cu0 2 3
окислитель
|
| 9. | Определить процесс окисления или восстановления (окислитель в процессе реакции восстанавливается, восстановитель окисляется). | -3+1 +2-2 0 0 +1-2
NH3+CuO→N2+Cu+H2O
2N-3 - 6℮ →N20 6 1 окисление  восстановитель 6
Cu+2 +2℮ →Cu0 2 3 восстановление
окислитель
восстановитель 6
Cu+2 +2℮ →Cu0 2 3 восстановление
окислитель
|
| 10. | Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса. Полученные коэффициенты поставить в правой части уравнения (после стрелки) перед теми элементами, напротив которых они стоят в окислительно-восстановительном балансе. Если атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения(в последнем уравнении для кислорода). | -3+1 +2-2 0 0 +1-2
NH3+CuO→N2+3Cu+H2O
2N-3 - 6℮ →N20 6 1 окисление  восстановитель 6
Cu+2 +2℮ →Cu0 2 3 восстановление
окислитель
Число отданных электронов
=
Число принятых электронов
восстановитель 6
Cu+2 +2℮ →Cu0 2 3 восстановление
окислитель
Число отданных электронов
=
Число принятых электронов
|
| 11. | Уравнять правую и левую части уравнения (проверить по кислороду, количество атомов кислорода справа и слева должно быть одинаковым). | -3+1 +2-2 0 0 +1-2
2NH3+3CuO→N2+3Cu+H2O
2N-3 - 6℮ →N20 6 1 окисление  восстановитель 6
Cu+2 +2℮ →Cu0 2 3 восстановление
окислитель
восстановитель 6
Cu+2 +2℮ →Cu0 2 3 восстановление
окислитель
|
| 12. | Устно проверьте правильность составленного уравнения. | Число атомов каждого химического элемента в правой и левой частях уравнения - одинаково. |
Окислительно-восстановительные реакции очень распространены. С ними связаны не только процессы коррозии, но и брожение, гниение, фотосинтез, процессы обмена веществ, протекающие в живом организме. Их можно наблюдать при сгорании топлива. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.
Упражнения.
№1 Прочитайте теорию, выпишите в тетрадь важнейшие понятия теории химических связей и выучите их (химическая связь, ковалентная связь, электроотрицательность, ионная связь, π- и σ-связи, полярные связи, металлическая связь, кристаллическая решетка, ОВР, окислитель и окисление, восстановитель и восстановление)
№2 Что такое химическая связь? Какие виды связи бывают?
№3 Какая связь называется ковалентной? Для каких веществ она характерна? Приведите примеры.
№4 Чем похожи и чем отличаются ковалентная полярная и ковалентная неполярная связь? Может ли существовать в одной молекуле разные виды связей?
№5 Какая связь называется ионной? Для каких веществ она характерна? Приведите примеры
№6 Чем похожи и чем отличаются π- и σ –связи? Какая из них более прочная?
№7 Какая химическая связь характерна для металлов? За счет чего она образуется?
№8 Какие виды кристаллических решеток вам известны? Какая из них самая прочная? Какая самая непрочная? Почему?
№9 Какое правило используют для вычисления степени окисления элементов в сложном соединении?
№10 Что такое ОВР? Какую роль играют процессы окисления в организме человека? Напишите реферативное сообщение по этой теме.
№11 Распределите вещества на четыре группы, по видам химической связи:
Na, N2, P2O5, NH3, Fe2O3, CaCl2, Cu, P4, CS2, Na3N, H2O, C, Zn, HF
№12Запишите схему образования молекул, укажите тип связи:
Br2, HCl, H2O, O2, KCl, Na2S
№13 В какой молекуле ковалентная связь более полярная в HF или в HI? Почему?
№14 Какая кристаллическая решетка
а) у нафталина, б) у воды, в) у хрома, г) алмаза, д) у поваренной соли? Ответ поясните.
№15 Определить степень окисления всех элементов входящих в состав соединений: H2, MgCl2, N2O3, Al2(SO4)3, Na2O, Ca, O2, Al2O3, H3P, Ba(NO3)2.
№16. Какой процесс - окисления или восстановления отражает схема? Укажите количество электронов, отданных или присоединенных элементами: а) Cu+2…..=>Cu0; б) Cl-…..=>Cl0;
В) N-3…..=>N+2.
№17. Определите степень окисления хрома в соединениях. В каких из них для хрома характерны свойства только восстановителя? В каких - только окислителя? Ответ поясните.
Cr2O3 , Na2CrO4, CrCl2, CrSO4, K2Cr2O7, Cr
№18.. Определите степени окисления элементов. Обозначьте переход электронов, окислитель и восстановитель. Расставьте коэффициенты в ОВР методом электронного баланса.
а) N2 + H2 → NH3
б) Fe2O3 + CO 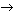 Fe + CO2.
Fe + CO2.
в) NO + O2 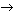 NO2.
NO2.
г) K2S + HNO3 = KNO3 + S + NO2 + H2O
д) Cu2O + HNO3 = Cu(NO3)2 + NO + H2O
е) KI +KMnO4 + H2SO4 = I2 +MnSO4 + K2SO4 + H2O