Пример 2.
Вычислить константу равновесия реакции окисления железа (II) бихроматом в стандартных условиях.
Решение:
Уравнение реакции:
1│  + 14
+ 14 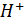 + 6e = 2
+ 6e = 2 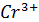 + 7
+ 7 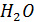
 = 1,36 В
= 1,36 В
6│ 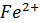 - e =
- e = 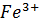
 = 0,77 В z = 6
= 0,77 В z = 6
________________________________________________
 + 14
+ 14 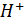 + 6
+ 6 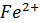 = 2
= 2 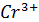 + 6
+ 6 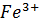 +7
+7 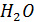
Константа равновесия данной реакции
lgKp = 6 *  = 6 *
= 6 *  = 60 , Kp =
= 60 , Kp = 
Если в полуреакции принимают участие ионы водорода, то ее можно записать в следующем виде:
Ох + nе + q 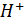 = Red +
= Red +  (7)
(7)
а формула Нернста примет вид
E =  +
+  * lg
* lg  (8)
(8)
Потенциал  относится к стандартному состоянию, когда рН =0. При другой постоянной кислотности раствора уравнение (7) примет вид:
относится к стандартному состоянию, когда рН =0. При другой постоянной кислотности раствора уравнение (7) примет вид:
E =  +
+  * lg
* lg  , где
, где  =
=  –
–  * pH (9)
* pH (9)
 является реальным (условным) нулевым потенциалом, характеризующим окислительные свойства вещества в конкретных.условиях, легко оценивается и используется в практических расчетах.
является реальным (условным) нулевым потенциалом, характеризующим окислительные свойства вещества в конкретных.условиях, легко оценивается и используется в практических расчетах.