Бинарные соединения водорода
Соединения элементов с водородом, весьма разнообразны по своим физическим и химическим свойствам.
Водородистые соединения щелочных и щелочно-земельных металлов – NaH, KH, CaH2, BaH2 – солеподобные вещества, в которых степень окисления водорода составляет (–1). При действии воды эти вещества разлагаются с выделением водорода:
NaH + H2O Þ H2 + NaOH.
Системетические названия солеподобных гидридов образуются по общим правилам, например:
NaH – гидрид натрия, CaH2 – гидрид кальция
Соединения с водородом элементов главных подгрупп IV – VII групп Периодической системы представляют собой легко летучие жидкости и газы. Степень окисления водорода в них (+1). Соединения, в которых элемент имеет электроотрицательность близкую электроотрицательности водорода (CH4, SiH4, GeH4, SnH4, PH3, AsH3, SbH3 и др.) практически мало растворимы в воде и их водные растворы не обладают ни кислотными, ни основными свойствами. Соединения, в которых электроотрицательность элементов больше электро-отрицательности водорода (HF, HCl, HBr, HI, H2S, H2Se, H2Te, NH3), хорошо растворяются в воде. Для всех соединений водорода(+1) используются традиционные названия:
CH4 – метан, SiH4 – силан, GeH4 – герман
NH3 – аммиак, РН3 – фосфин, AsH3 – арсин, SbH3 – стибин
Н2О – вода, H2S – сероводород, H2Se – селеноводород
HF – фтороводород, HCl – хлороводород,
HBr – бромоводород, HI – иодоводород
Водные растворы HF, HCl, HBr, HI, H2S, H2Se, H2Te являются кислотами, поэтому их называют добавляя слово «кислота» к традиционному названию вещества, например:
HF – фтороводородная кислота,
HCl – хлороводородная кислота,
H2Se – селеноводородная кислота
Следует отметить, что для растворов HF и HCl в основном используют исторические названия – «плавиковая кислота» и «соляная кислота» соответственно.
С переходными металлами (d-элементами) водород образует нестехиометрические соединения, свойства которых в этом издании не рассматриваются.
Оксиды
Оксидами называют бинарные соединения кислорода, в которых кислород проявляет степень окисления (–2).
Написание эмпирических формул и название оксидов выполняется по правилам номенклатуры бинарных соединений, например:
СО – монооксид углерода или оксид углерода(+2),
Ag2O – оксид серебра(+1),
SO2 – диоксид серы или оксид серы(+4),
СаО – оксид кальция
RuO4 – тетраоксид рутения или оксид рутения(+8),
В2О3 – оксид бора
Рассмотрим изображение графических формул. В графических формулах отражается не только качественный и количественный состав соединения, но и порядок соединения атомов в соединении, а также число химических связей между атомами. Для определения числа химических связей необходимо знать валентность элемента.
Под валентностью элемента понимают число электронных пар, которые соединяют атом элемента с другими атомами. В графических формулах связывающую электронную пару обозначают валентным штрихом « –– » . Валентность элемента в соединении в большинстве случаев совпадает с численным значением степени окисления элемента. Поэтому степень окисления элемента помогает при изображении графических формул. Так как в оксидах кислород имеет степень окисления (–2), то его валентность равна 2, при этом атом кислорода с другими атомами может образовывать двойные и одинарные связи. В последнем случае атом кислорода выполняет роль мостика между атомами другого элемента (Э–О–Э).
Примеры графических формул оксида свинца(+4) и оксида мышьяка(+3):
PbO2 Þ Pb+4O2–2 Þ O=Pb=O
As2O3 Þ As2+3O3–2 Þ O=As–O–As=O
Следует помнить, что в оксидах атомы кислорода не бывают связаны друг с другом, а атомы второго элемента, как правило, связаны через кислородный мостик.
По своим химическим свойствам оксиды подразделяются на две группы – солеобразующие и несолеобразующие. Несолеобразующих оксидов немного – это СО, SiO, N2O и NO. Подавляющее большинство оксидов относятся к группе солеобразующих. Солеобразующие оксиды по характеру реакций солеобразования подразделяют на основные оксиды, кислотные оксиды и амфотерные оксиды.
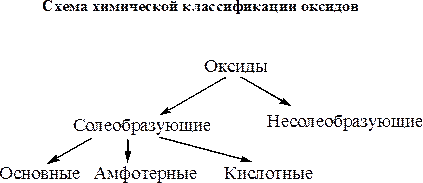
Основными называются оксиды, способные вступать в реакции солеобразования с кислотными оксидами и кислотами.
Пример
Основной характер оксида кальция проявляется в реакциях
CaO + CO2 Þ CaCO3
CaO + H2SO4 Þ CaSO4 + H2O.
Кислотными называются оксиды, способные вступать в реакции солеобразования с основными оксидами и основаниями.
Пример
Кислотный характер оксида серы(+6) проявляется в реакциях.
SO3 + MgO Þ MgSO4
SO3 + 2NaOH Þ Na2SO4 + H2O.
Амфотерные оксиды проявляют свойства и основных и кислотных оксидов, т.е. вступают в реакции солеобразования с кислотными и основными оксидами, а также с кислотами и основаниями.
Пример
Амфотерный оксид цинка взаимодействует с кислотными оксидами и кислотами:
ZnO + SO3 Þ ZnSO4
ZnO + 2HNO3 Þ Zn(NO3)2 + H2O,
а также с основными оксидами и со щелочами:
ZnO + CaO Þ CaZnO2
ZnO + 2NaOH расплав Þ Na2ZnO2 + H2O
ZnO + 2NaOH раствор + H2O Þ Na2[Zn(OH)4].
Некоторые основные и кислотные оксиды могут взаимодействовать с водой, например:
CaO + H2O Þ Ca(OH)2
SO3 + H2O Þ H2SO4.
Характер оксидов большинства элементов можно определить, руководствуясь следующими правилами:
I. Элементы-неметаллы образуют только кислотные оксиды.
Элементы-неметаллы располагаются в Периодической системе в главных подгруппах на диагонали B–Si–As–Te–At и правее её. Таким образом, к неметаллам относят 22 элемента. Остальные элементы относят к металлам.
II. Элементы-металлы в высоких степенях окисления (+8, +7, +6, +5) образуют только кислотные оксиды.
III. Металлы в степени окисления (+1) образуют только основные оксиды.
IV. Оксиды металлов в степенях окисления (+2) и (+3) могут быть основными и амфотерными, а в степени окисления (+4) – амфотерными и кислотными.
V. С уменьшением степени окисления металла от высшей к низшей характер его оксидов изменяется от кислотного к основному.
Пример
Марганец в соединениях с кислородом проявляет степени окисления от +2 до +7. Очевидно, что оксид марганца(+7) кислотный, у оксида марганца(+2) преобладает основной характер, оксид марганца(+4) – амфотерный.
| Степень окисления | Формула оксида | Характер оксида |
| +7 | Mn2O7 | кислотный |
| +4 | MnO2 | амфотерный |
| +2 | MnO | основной |
Применение указанных правил для определения характера оксидов МО2, М2О3 и МО существенно облегчается, если известны амфотерные оксиды элемента. Для запоминания амфотерных оксидов полезна следующая информация.
Элементы главных подгрупп расположенные в Периодической системе на ломаной линии Be–Al–Ge–Sn–Pbимеют оксиды только амфотерного характера. Элементы расположенные рядом с этой линией – Ga, In и As, Sb имеют амфотерные оксиды – Ga2O3, In2O3 и As2O3, Sb2O3. У оксида As2O3 ярко выражены кислотные свойства и очень слабо основные свойства.
Для элементов побочных подгрупп необходимо запомнить следующие амфотерные оксиды:
CuO Au2O3 ZnO CdO Cr2O3 MnO2.
У некоторых элементов существуют смешанные оксиды, в которых атомы элемента находятся в двух степенях окисления, например, Fe3OУ некоторых элементов существуют смешанные оксиды, в которых атомы элемента находятся в двух степенях окисления, например, Fe3O4 (Fe+2,+3), Pb3O4, Pb2O3 (Pb+2,+4) и др.. Среди кислотных оксидов следует отметить смешанные ангидриды. В последних элемент имеет неустойчивую степень окисления, поэтому реакции солеобразования сопровождаются окислительно-восстановительными превращениями с образованием двух солей, в которых элемент приобретает ближайшие устойчивые степени окисления, например:
2N+4O2 + 2KOH Þ KN+3O2 + KN+5O3 + H2O
2Cl+6O3 + 2KOH Þ KCl+5O3 + KCl+7O4 + H2O.