ЛАБОРАТОРНАЯ РАБОТА №1
«Изучение зависимости стационарного потенциала металла от рН коррозионной среды»
Цель работы: получение зависимости стационарного потенциала металла от рН коррозионной среды
Оборудование: иономер, стеклянный электрод, хлорсеребряный электрод, два химических стакана на 200 мл, исследуемый электрод, бюретка для титрования, образцы металлов (алюминия, железа, цинка, меди, стали, латуни, бронзы и т.д.)
Реактивы: 0,1 Н раствор HCl (приготовленный из фиксанала); 0,1 Н раствор NaOH; раствор морской соли 10%; 0,25 Н раствор уксусной кислоты СН3СООН; растворы NaCl с известным значением рН среды.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Потенциал изолированного металла в растворе собственных ионов принимает равновесное значение вследствие того, что устанавливаются равные скорости ионизации металла и обратного процесса разряда ионов металла из раствора. Оба эти процесса сбалансированы, и количество вещества, переносимое в единицу времени через границу металл-раствор в одном и другом направлении, одинаково, как и количество электрических зарядов. Благодаря этому не происходит потери металла, а его потенциал сохраняет своё постоянное значение (что является признаком баланса электрических зарядов).
Поместим теперь металл в раствор кислоты. Как показывает опыт, его потенциал также принимает постоянное значение, однако этот потенциал не является равновесным. Это следует из того, что металл непрерывно переходит в раствор.
Потенциал, при котором протекает электрохимическая коррозия носит название стационарного потенциала Ест. Постоянство во времени Ест указывает, что и в данном случае соблюдается баланс электрических зарядов, притекающих к поверхности металла из раствора и уходящих с металла в раствор. Однако на этот раз материальный баланс вещества уже не имеет места.
В результате растворения металла возле его поверхности в растворе образуется некоторое количество одноименных ионов и это создает условие для протекания обратного процесса разряда этих ионов на металле. Следовательно, уже имеются два сопряженных электрохимических процесса: ионизация металла и разряд его ионов. Но в отличие от равновесного металлического электрода в данном случае эта пара электрохимических процессов не является единственной. На поверхности металла происходит также разряд водородных ионов и водород удаляется в виде пузырьков в атмосферу, но наряду с этим частично протекает эго ионизация, т.е. обратный переход ионов водорода в раствор. Это дает вторую пару сопряженных процессов, протекающих на поверхности металла. В зависимости от рН среды на каждом конкретном металле, буду протекать свои сопряженные процессы.
Зависимость стационарных потенциалов металлов от концентрации водородных ионов линейна и может быть определена соотношением:
0,0591
Ест=Е0ст - ----------рН (1)
α1z+β2
Угловой коэффициент прямой Ест – рН отличается от значения (2,3RT)/F для водородного электрода, поскольку сумма α1z+β2 не равна единице.
Влияние рН, на скорость коррозии растворяющегося металла, может быть выражена соотношением:
α1z
lg iкорр= const - ---------- рН (2)
α1z+β2
1.1. Влияние pH. Диаграммы Пурбе.
Диаграмма Пурбе для системы Al – H2O.
Диаграммы потенциал-рН для железа.
При решении коррозионных проблем очень полезно использование диаграмм потенциал — рН, называемых также диаграммами Пурбе по имени бельгийского ученого. На рисунке представлена упрощенная диаграмма Пурбе для железа, помещенного в водный раствор электролита при температуре 25°С и концентрации ионов металла 10-6 моль на литр раствора.
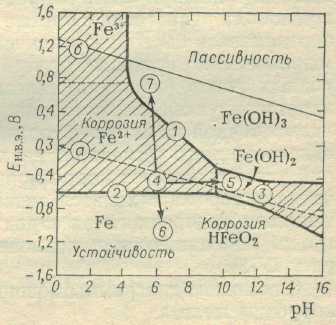
Рис.2. Диаграмма потенциал—рН дня железа
В случае более низкой концентрации ионов Fe2+ условно считают, что железо не корродирует.
Наклонная линия а выражает равновесный потенциал водородного электрода в зависимости от рН, линия б — равновесный потенциал кислородного электрода. Потенциал как водородного, так и кислородного электрода уменьшается на 0,059В при возрастании рН на единицу. Между линиями а и б находится область термодинамической устойчивости воды, ниже линии а происходит восстановление воды с выделением водорода, выше линии б — окисление воды с выделением кислорода.
Непрерывные линии определяют границы участков устойчивости, пассивности и коррозии железа при разных значениях потенциала и рН. Все наклонные линии соответствуют равновесиям процессов окисления и восстановления, зависящим от рН, например:
Fe2+ + ЗН2О → Fe(OH)3 + 3H+ + е (линия 1)
Горизонтальные линии соответствуют равновесиям, не зависящим от рН:
Fe → Fe2+ + 2e (линия 2).
Вертикальные линии соответствуют равновесиям, не зависящим от потенциала:
Fe3+ + 3H2O → Fe(ОН)3 + ЗН+ (вертикальный участок линии 1).
Fe(OH)2 → HFeO2- + Н+ (линия 3).
Диаграмма указывает на существование двух областей коррозии железа: одной, где образуются ионы Fe2+ и Fe3+ (в средах с рН ниже 9) и другой, где возникают ионы HFeO2- (в сильнощелочных средах). Если бы, например, железный электрод, погруженный в деаэрированный раствор с рН = 6, находился только в условиях равновесия с ионами Fe2+, то величина его потенциала определялась бы горизонтальной линией 2. Однако на электроде одновременно протекает другой процесс — восстановление водородных ионов (коррозия железа с водородной деполяризацией), характеризующийся потенциалом, значение которого определяется точкой на линии а, соответствующей рН = 6. В результате одновременного протекания двух сопряженных электродных реакций устанавливается коррозионный (смешанный) потенциал, значение которого находится между значениями равновесного потенциала водородного электрода и потенциала железного электрода, находящегося в равновесии с ионами Fe2+ (точка 4 на рис.2).
С помощью диаграммы можно определить способы уменьшения коррозии железа:
Протекторная и катодная защита.
Протекторная и катодная защита заключается в катодной поляризации металла до потенциала, при котором замедляется процесс ионизации. Источником поляризующего тока может быть гальванический элемент: защищаемая металлическая конструкция - электрод с весьма отрицательным потенциалом (протектор) или внешний источник постоянного тока.
Система алюминий — вода. В данной системе можно представить небольшое число реакций, если считать, что окисление алюминия идет в одну ступень до трехвалентного состояния. Это следующие реакции и соответствующие им уравнения, определяющие равновесные потенциалы, активности потенциалопределяющих ионов и рН раствора:
1. Аl= Аl3+ +3e,
Равновесные потенциалы сопряженных катодных реакций даны соответственно линиям а и б при rh = 0 и гО = 0 (рис.3).
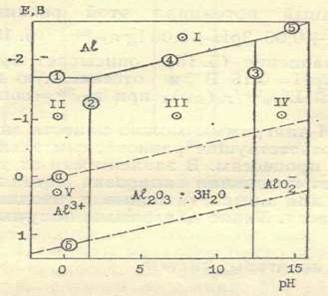
Рис.3. Е,рН-диаграмма системы алюминий – вода
Если активность потенциалопределяющих ионов принять равной единице, то получим Е, рН - диаграмму для этой системы (см. рис.3). Прямые, отвечающие тем или иным равновесным реакциям, обозначены номерами соответствующих химических уравнений. Рассмотрим как используется диаграмма для определения термодинамически возможных анодных и катодных коррозионных процессов на алюминии в воде, когда активность потенциал - определяющих ионов равна единице, р=1 атм, Т = 298К.
Возьмем точку J (см. рис.3). Это область отрицательных потенциалов, когда процессы анодного растворения алюминия невозможны, но термодинамически вероятны катодные реакции восстановления растворенного кислорода (б), ионов водорода (а) и гидроксида алюминия (4). Следовательно, в точке J коррозии алюминия не будет. Если потенциал алюминия равен значению ординаты точки II, то должно идти анодное растворение по реакции 1, а катодными процессами будут реакции а и б, т. е. при этом потенциале алюминий должен разрушаться. Действительно, алюминий в кислых средах испытывает значительную коррозию. Теперь изменим рН раствора до точки III. Анодным процессом здесь уже будет реакция 4, а катодные процессы останутся прежними. В таком случае коррозия алюминия термодинамически неизбежна, но практически ее не будет, так как образовавшийся по реакции 4 гидроксид покрывает поверхность алюминия и тормозит протекание коррозионных процессов. Увеличивая значение рН раствора, приходим в точку IV, когда становится возможной реакция 5 собразованием растворимых продуктов. Алюминий при таких значениях рН раствора, как и в кислых средах, коррозионно неустойчив. При потенциалах точки V, как и во втором случае (точка II), идет анодное растворение алюминия (реакция 1),но катодной реакцией будет только восстановление кислорода. При более положительных потенциалах, чем потенциал линии б, исключаются все катодные процессы и остаются только анодные. Коррозии как сопряженного процесса анодных и катодных реакций при этом не будет. Алюминий выступает как анод, на котором протекают только анодные процессы.
Рассмотренная Е, рН-диаграмма для системы алюминий — вода является неполной, так как в ней не учтена возможность образования катионов AlOH2+ Al(OH)2+, отвечающих основным солям алюминия. В щелочных растворах помимо алюмината AlO2-, видимо, может образовываться также Н2AlO3. Гидроксид алюминия имеет несколько модификации различной степени гидратации, что также не учтено.
Вводных растворах основная анодная реакция.
(1.2)
На диаграмме «электродный потенциал -- рН» (диаграмме Пурбе) область реакции (1.2) находится при рН, больших определяемых уравнением
(1.3)
Уравнение, связывающее потенциал и рH:
(1.4)
Основной катодный процесс в нейтральной среде, сопряженный с реакцией (1.2):
(1.5)
На диаграмме Пурбе область ее осуществления ограничена линией, уравнение которой
(1.6)
Для реализации ВО необходим процесс водородной деполяризации, который в нейтральной среде представлен реакцией
(1.7)
(1.8)
Реакция (1.7) возможна при потенциалах отрицательнее (1.8) и рН, меньших определяемых уравнением (1.3). Такие условия возникают в питтингах и трещинах за счет реакцIV, когда становится возможной реакция 5 собразованием растворимых продуктов. Алюминий при таких значениях рН раствора, как и в кислых средах, коррозионно неустойчив. При потенциалах точки V, как и во втором случае (точка II), идет анодное растворение алюминия (реакция 1),но катодной реакцией будет только восстановление кислорода. При более положительных потенциалах, чем потенциал линии б, исключаются все катодные процессы и остаются только анодные. Коррозии как сопряженного процесса анодных и катодных реакций при этом не будет. Алюминий выступает как анод, на котором протекают только анодные процессы.
Рассмотренная Е, рН-диаграмма для системы алюминий — вода является неполной, так как в ней не учтена возможность образования катионов AlOH2+ Al(OH)2+, отвечающих основным солям алюминия. В щелочных растворах помимо алюмината AlO2-, видимо, может образовываться также Н2AlO3. Гидроксид алюминия имеет несколько модификации различной степени гидратации, что также не учтено.
Вводных растворах основная анодная реакция.
(1.2)
На диаграмме «электродный потенциал -- рН» (диаграмме Пурбе) область реакции (1.2) находится при рН, больших определяемых уравнением
(1.3)
Уравнение, связывающее потенциал и рH:
(1.4)
Основной катодный процесс в нейтральной среде, сопряженный с реакцией (1.2):
(1.5)
На диаграмме Пурбе область ее осуществления ограничена линией, уравнение которой
(1.6)
Для реализации ВО необходим процесс водородной деполяризации, который в нейтральной среде представлен реакцией
(1.7)
(1.8)
Реакция (1.7) возможна при потенциалах отрицательнее (1.8) и рН, меньших определяемых уравнением (1.3). Такие условия возникают в питтингах и трещинах за счет реакции гидролиза (1.3):
(1.9)