ФЕРМЕНТТЕР (ЭНЗИМДЕР)
Ферменттердің жалпы сипаттамасы
Ағза торшаларының тіршілік етуі, қызметі, оларда өтетін химиялық реакция өнімдерінің түзілуі жылдамдығына тәуелді процесс. Реакция жылдамдығы оларға әсер етуші заттар - катализаторларға тығыз байланысты. Катализатор реакцияға қатысып, оның жылдамдығын жоғарылатады және реакция соңында бастапқы қалпына келеді.
Ферменттер торшаларда синтезделіп, биохимиялық реакцияларға қатысатын белоктық табиғаттағы биокатализаторлар.
Энзимология — ферменттерді зерттейтін ғылым саласы. Ол басқа ғылымдар биология, генетика, фармакология, химиямен тығыз байланысты.
Фермент немесе энзим (лат. fermentum — ашу; en — ішінде, zim — ашытқы Ван Гельмонт, 19 ғ. ұсынған) алғашқыда ашыту процестерінде анықталған зат.
Ферменттердің қызметі туралы алғашқы ғылыми еңбекті Кирхгофф (1814) жариялады. Кейін ашу процесі ашытқы торшаларында ғана өтеді деген ұйғарым жасаған Л. Пастерге (1871), Либих ферменттер торшалардың өмір сүруіндегі пайда болған өнім ол торшада да, олардан бөлек те қызмет атқарады деген қарсы пікір білдірді. Либихтің ғылыми көзқарасы М. Манассейна (1871), Бухнер (1897) зерттеулерінде эксперимент жүзінде дәлелденді.
Торшаларда синтезделген ферменттер өзіне тән арнайы қызметте-
рін ағзаның барлық мүшелерінде атқарады. Олардың табиғаты белок екені Зеренсон (1909), И.П. Павлов — пепсинді зерттеуінде, А.М. Данилевский — ферментті (липазаны) талғамды бөліп алуы, Самер (1926) — уреазаны кристалл түрінде алғаш алуы, Нортроп (1930) — пепсин, трипсинді таза күйінде бөліп алуы еңбектері негізінде дәлелденді. Ферменттік қасиет, негізінен, глобулалық құрылымдағы белоктарға тән екені белгілі болды. Бірақ, қазіргі кезде, кейбір құрылымдық белоктар да (фибриллалық белоктар — актин, миозин) каталиттік активтілік көрсететіні байқалған.
Ферменттер белоктарға тән физика-химиялық қасиеттерді байқатады. Сондықтан олар коллоидтық ерітінділер түзеді, молекулалық массасы 10000-нан, бірнеше млн далтон аралығында болады, ертінділері амфотерлік электролиттік қасиет көрсетеді. Кристаллдарының құрамында су молекуласы болады, ал толық сусызданған фермент кристаллы каталиттік активтілігін жоғалтатыны байқалған. Кеңістікте ұйымдасқан құрылымдық конформациясы бойынша белоктық глобулалық және фибриллалық формаларды қайталайды. Сонымен бірге, ферменттердің өзіне тән кейбір қасиеттеріне олардың термолабилділігі, әсер ету ерекшелігі, активтілігінің реттелуі жатқызылады.
Ферменттік реакция. Ферменттер өз әсерлерін микрогетерогендік (өте аз мөлшерде) катализаторға ұқсас жүргізеді. Фермент өзінің әсер етуші заты субстратпен (S) ферменттік реакция жүргенде фермент-субстрат комплексін (аралық зат) түзеді. Бұл комплекстің қызметі өте күрделі, ол субстрат пен фермент молекулаларының конформациялық өзгеруі, энергия өзгерістері және химиялық байланыстар өзгерулеріне әкеледі. Реакция өткеннен соң фермент-субстрат комплексі жаңа қалыпқа ауысып фермент-реакция өнімі комплексіне айналады. Содан кейін ол фермент және реакция өніміне (Р) жекеленіп бөлінеді
S + E → S·E → EP → E + P
Жай химиялық реакциялардан катализдік реакцияның айырмашылығы тәріздес бейорганикалық катализатор мен биокатализатордың да өзіндік ерекшеліктері болады.
 Ферменттердің катализаторлық ерекшелігіне келесі қасиеттері жатқызылады:
Ферменттердің катализаторлық ерекшелігіне келесі қасиеттері жатқызылады:
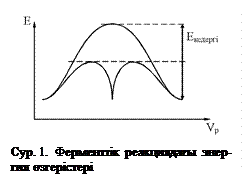
а) Фермент өздігінен жаңа реакция жүргізбейді. Ол тек термодинамикалық мүмкін реакцияны ғана жүргізеді. Реакция барысында активтелу энергиясы төмендейді. Графикте көрсетілгендей реакцияның үлкен кедергі энергиясын сатылап бөліп төмендету және активтелу энергиясын жоғарлату арқылы реакция жылдамдығын жоғарлатады.
б) Фермент басталған реакцияның бағытын өз бетінше өзгерте алмайды. Ол бір ғана реакция өнімі түзілуі бағытында жұмыс істейді. Мысалы, глюкокиназа глюкозадан тек глюкоза-6-фосфат түзілуін жүргізеді.
в) Фермент қатысатын реакция қайтымды болса, ол реакцияны екі бағытта да жүргізе алады. Мысалы, көмірсулардың гликолиттік ыдырауына қатысатын фосфогексоизомераза, альдолаза, фосфоглицераткиназа, фосфоглицератлидаза және т.б.
г) Фермент реакцияға өте аз мөлшерде қатысады. Ферменттің бір молекуласы 1 минутта 1000-нан млн-ға дейін субстрат молекуласына әсер ете алады. Бұл көрсеткіш карбангидраза ферментінде 36 млн-ға дейін жетеді.
д) Фермент реакция өткеннен соң өзінің бастапқы қалпына қайта келеді. Сондықтан ол субстраттың жаңа молекуласына әсер етуге қашанда дайын болады.
е) Ферментативті реакцияның жоғарғы активтілігі оның реакцияны бейорганикалық катализаторлардан да жоғары жылдамдықта жүргізе алатындығы. Мысалы, белоктың аминоқышқылдарға дейінгі гидролиттік ыдырауын бейорганикалық катализатор (күшті қышқыл, сілті қатысуында) жоғары температурада (Т = 100° С) бірнеше сағатта жүргізсе ферменттер төменгі температурада (Т = 30—40° С) бірнеше минутта жүргізеді.
ж) Арнайы субстраттық ерекшелігінің өте жоғары дәрежелілігі. Фермент реакциялық қоспадан реакция өнімін беретін субстратты таңдай алады және тек сонымен ғана реакцияға түседі.
з) Ферментативті реакцияны реттеуге болатындығы. Бұл фермент молекуласында болатын активті орталыққа, субстрат мөлшеріне, фермент мөлшеріне, ортаның факторларына (рН, Т, қысым) байланысты. Сондықтан торшаларда мыңдаған реакциялар белгілі бір ретпен және қажеттілігіне сәйкес жүреді.
Ферменттердің құрылымдық ұйымы. Химиялық құрылысы бойынша ферменттер протеин (жай белоктар) және протеид (күрделі белоктар) болып бөлінеді. Фермент-протеиндердің активтілігі сол белоктың құрылымына байланысты. Фермент-протеидтердің активтілігі белоксыз табиғаттағы топ — кофакторға тығыз байланысты. Күрделі құрылыстағы ферментті — фермент-протеид, қос компонентті немесе холофермент, ал оның белоктық бөлігін белоктық компонент, немесе феррон (алып жүруші), немесе апофермент және қосымша топты простетикалық топ, немесе агон (активті топ), немесе кофермент (кофактор) деп атайды. Простетикалық топтың ерекшелігі ол апоферментпен мықты байланысады және ажыратылмайды. Мысалы, цитохром С-дағы гемдік топ белокпен ковалентті байланысқан, кофермент апоферменттен жеңіл бөлінеді, бірнеше ферментке қызмет ете алады және өз бетінше де өмір сүре алады. Ол коваленттік байланысқан болады. Простетикалық топтарға және коферментке витаминдердің туындылары, нуклеотидтер және олардың туындылары, кейбір моносахаридтердің фосфорлық эфирлері, тетрапирролдар мен металл құрамды порфириндер, глутатион (пептидтер) жатқызылады.
Кофактор (кофермент) апоферменттің каталиттік активті конформациясының (ү.р.қ. немесе т.р.қ.) тұрақты қалыптасуын камтамассыз етеді. Активті орталықтың құрамына кіріп, катализге тікелей қатысады, апоферменттің әсер ету ерекшелігіне ықпал етеді. Апофермент ферменттің өзіне тән субстраттық ерекшелігі мен жоғары каталиттік активтілігін қамтамассыз етеді. Сондықтан апофермент пен кофермент байланыспаған болса фермент өзінің каталиттік қызметін атқара алмайды.
Ферментте каталиттік қызметті кофермент атқарады. Оның әсері белоктық полипептидтік фрагменттің қатысуынсыз жүрмейді.
Коферменттердің қызметі олардың электрондарды аралық тасымалдауда, кейбір атомдар мен қызметік топтарды (—H; —NH2; —CH3 және т.б.) бір қосылыстан екіншіге ауыстыру болып табылады. Нәтижесінде химиялық өзгерістер өтеді, жаңа өнім пайда болады.
Коферменттері-витаминдер (В1, В2, В3, В5, В6, В12, Н, Вс) немесе олардың туындылары (КоА, НАД, НАДФ, ФМН, ФАД) болатын ферменттер әртүрлі маңызды реакцияларды жүргізеді.
Пептидтердің коферменттік қасиеті олардың, мысалы, глутатион-SH (γ-глутамилцистеинилглицин) торшалардағы өтетін тотығу-тотықсыздану процесстеріне қатысуымен байланысты.
Нуклеотидтер мен олардың, туындыларының (аденозиндік, гуанозиндік, уридиндік, цитидиндік) коферменттік қызметі АТФ-тың фосфаттық қалдығы мен аденинді, фосфоаденозинфосфосульфаттың (ФАФС) — сулфаттық топты, S-аденозилметиониннің — метилдік топты, УДФ-тің — гликозилдік қалдық пен урон қышқылын, УДФ-тің — фосфохолинді тасымалдаушы заттары ретінде болуымен байқалады.
Металл иондарының коферменттік қызметі субтрат пен фермент арасында «көпір» тәріздес байланыс құруы арқылы және каталиттік қызметке тікелей қатысуы арқылы белгілі.
Сонымен бірге, кейбір моносахаридтердің фосфорлық эфирлері, липой қышқылдары және т. б. көптеген заттарда коферменттік қызметі атқаратындығы белгілі болды.
Бір ғана кофермент әртүрлі белоктарға байланысып әртүрлі реакцияларды катализдеуі мүмкін. Пиридоксальфосфат бір жағдайда трансаминденуді жүргізеді.
Бір компонентті ферменттердің (фермент-протеин) каталиттік қызметі құрылымында активтік каталиттік субстраттық, аллостерлік орталықтардың болуымен тығыз байланысты.
 Активті орталық. Фермент молекуласының полипептидтік тізбегі құрамындағы активті орталық белгілі бір аминоқышқылдардың ерекше жинақталған түрлері. Активті орталықтың құрамында негізінен серин, тирозин, гистидин, триптофан, аргинин, цистеин, аспарагин және глутамин қышқылдары кездеседі. Бұл аминоқышқылдардың радикалдары күрделі ферменттердегі кофермент тәріздес қызмет атқарады. Ферменттің активті орталығы белоктағы полипептид тізбегінің әртүрлі бөліктерінде орналасқан болады. Активті орталықтың құралуы белок молекуласының ү.р.қ. және т.р.қ., конформациялық деңгейлеріне қалыптасқанында өтеді.
Активті орталық. Фермент молекуласының полипептидтік тізбегі құрамындағы активті орталық белгілі бір аминоқышқылдардың ерекше жинақталған түрлері. Активті орталықтың құрамында негізінен серин, тирозин, гистидин, триптофан, аргинин, цистеин, аспарагин және глутамин қышқылдары кездеседі. Бұл аминоқышқылдардың радикалдары күрделі ферменттердегі кофермент тәріздес қызмет атқарады. Ферменттің активті орталығы белоктағы полипептид тізбегінің әртүрлі бөліктерінде орналасқан болады. Активті орталықтың құралуы белок молекуласының ү.р.қ. және т.р.қ., конформациялық деңгейлеріне қалыптасқанында өтеді.
Радикалдардағы қызметші топтар кеңістікте қозғалып каталиттік процесс өтетін орынға молекуланы глобус формасына айналдырып жиналады. Катализ жүруі үшін қызметші топтар қатаң түрде субстрат молекуласының реакция жүретін бөлігіндегі топтарына сәйкес келуі қажет. Әртүрлі факторлар әсерінен болатын үшінші және төртінші конформациялық деңгейлердің өзгеруі активті орталықтың өзгеруіне, сондықтан каталиттік активліктің өзгеруіне әкеледі.
Активті орталық қызметі әртүрлі екі бөлімнен тұрады: жанастырушы (якорлық) және каталиттік орталықтар.
Жанастырушы орталық. Жанастырушы орталық деп фермент молекуласындағы каталиттік реакцияға түсетін затты (субстратты) байланыстыруға жауап беретін бөлім.
Субстраттың фермент молекуласына бекітіліп орналасуы жанасу арқылы жүреді. Жанасатын бөлімдегі аминоқышқылдар радикалдары фрагментін «якорлық алаң» деп айтады. Жанастырушы орталықтың аминоқышқылдық құрам әр фермент үшін әртүрлі екендігі байқалады. Субстраттың жанастырушы орталыққа бекітілуі ферменттік реакция түріне байланысты әртүрлі аралықта орналасқан аминоқышқылдармен атқарылады. Бекіту процессі лизин қалдығындағы екінші амин тобы, немесе глутамин қышқылындағы екінші карбоксил тобы, немесе цистеин қалдығындағы сульфгидрилдік топтардың әсерлесуі арқылы өтетіні анықталған. Жанастырушы орталықтың маңызды қызметіне оның субстраттың молекуласын ферментке мықты бекітуі және оның құрамындағы реакцияға қатысатын топтарды активті орталыққа қатаң түрде тура әкелуі жатқызылады. Жанастырушы орталық фермент-субстрат комплексінің қалыптасуын қамтамассыз етеді және катализдің жүруіне жағдай жасайды.
Каталиттік орталық. Активті орталықтың каталиттік бөлімінде субстраттың химиялық өзгерісі өтеді, реакция өнімі түзіледі. Каталиттік орталықтың қызметі химиялық құрылысына байланысты әртүрлі. Бір компонентті ферменттерде олар полипептидтік тізбектегі сол орталыққа жиналған аминоқышқылдар радикалдарының қызметші топтарына байланысты, қос компонетті ферменттерде бұл кофакторға, оның табиғатына байланысты жүреді.
Қызметші топтар мен кофактор ферменттік реакциялардың түрлері мен реакция өнімдерін айқындайды.
Активті орталықтың қызметін жүйкеден қозу процессін бұлшықетке беруде маңызды роль атқаратын зат ацетилхолинді ыдыратушы холинэстераза ферментінің реакциясының механизмінен байқауға болады.

Холинэстеразаның активті орталығында серин, гистидин, тирозин және глутамин қышқылы болатыны анықталған.
Фермент-субстраттық комплекс ферменттегі глутамин қышқылы радикалындағы теріс зарядқа иондалған карбоксил тобы мен ацетилхолиндегі (субстрат) оң зарядтағы азот атомы арасындағы электрлік әсерлесу арқылы қалыптасады. Пайда болған комплексте серин радикалындағы (кофермент, КоА) сульфгидрилдік топ

ацетилхолиннің карбонилдік тобымен әсерлеседі. Сонан кейін ацетилхолиндегі эфирлік байланыстағы оттегімен тирозин радикалының гидроксилдік топтары арасында әсерлесу өтеді. Сол себепті, ацетилхолин молекуласындағы карбонилдік топ пен эфирлік оттегі арасындағы байланыс әлсізденеді. Соның нәтижесінде ацетилхолин молекуласы активтеніп кедергілік энергиясы (Ек) төмендейді. Ары қарай гистидин радикалындағы оң зарядталған азот (N+) сериндегі сульфгидрилдік топтың протонын өзіне тартады. Бұл серин мен сірке қышқылы қалдығының арасында мықты байланыс түзілуіне жағдай жасап, ол тирозиннен бөлінген протонның холин қалдығына ауысуына әкеледі. Нәтижесінде ацетилхолин молекуласы екіге бөлінеді. Судағы сутегі мен гидроксил топтары арқылы ферменттің активті орталығы қайта қалпына келеді. Фермент-субстрат комплексі бір бірінен ажырайды.
Ферментердің жоғары каталиттік қабілеті қамтамассыз етіледі:
— ферменттер субстраттарды өзіне тартып, оларды активті орталыққа реакция өтетін орынға ыңғайлы бағыттап байланыстырады;
— ферменттегі қышқылдық, сілтілік топтар протонның субстратқа жеңіл ауысуына ыңғайлы орналасады;
— фермент молекуласындағы белгілі бір топтар субстратпен коваленті байланысып оның реакцияға қабілетті құрылысқа өтуіне жағдай жасайды;
— фермент субстрат молекуласында энергетикалық өзгерістерді өткізіп химиялық реакцияны жүргізеді.
Аллостерлік орталық. Фермент молекуласы әдетте активсіз күйде болады. Торша ішінде кездесетін кез келген кіші молекулалы заттар (витаминдер және олардың туындылары, металл иондары және т. б.) фермент молекуласының белгілі бір бөлігіне әсер еткенде ол активтелінеді. Активтендіруші заттарды аллостерлік эффектор, ал олар әсер ететін белоктағы полипептидтік бөлім аллостерлік орталық деп аталады. Аллостерлік орталық белоктың каталиттік қызмет атқара алатын ү.р.қ. және т.р.қ. денгейлері қалыптасуын қамтамассыз етеді.
Аллостерлік орталыққа әсер ететін заттарды екі топқа бөледі —активаторлар және ингибиторлар.
Активаторлар әсер еткенде белок молекуласы активті қалыпқа келеді. Ингибиторлар әсер етсе оның активтілігі тежеледі. Бұл процесс фермент активтілігінің реттелуінде маңызды роль атқарады. Қандайда бір затты активаторға немесе ингибиторға қатаң түрде жатқызуға болмайды. Активатор ретінде болған зат ингибитор ретінде де әсер ете алады, олар тек белгілі бір информацияны ғана бере алуы мүмкін. Ал қай кезде активті немесе пассивті формада болу фермент молекуласының ішкі құрылымдық механизмдеріне байланысты болуы мүмкін.
Активті-, жанастырушы-, аллостерлік орталықтар фермент молекуласының белгілі бір бөлімдері екендігі, шын мәнінде, шартты түрде қабылданған ұғымдар. Ферменттегі активті орталық, жанастырушы орталыққа сәйкес келуі де мүмкін. Немесе, аллостерлік орталықсыз да фермент активтілігі басқа факторлар арқылы да (құрылымдық деңгейінің өзгеруі, субстраттың жанастырушы орталыққа өздігінен байланысуы, қоршаған орта әсерлері) реттелуі мүмкін.
Фермент пен субстрат әсерлесуі олардың молекулалық құрылысының жалпы сәйкестілігіне (жалпы комплементарлылығына) тәуелді болады. Субстрат пен активті орталықтың аталған қасиетке бағынуы олардың әсерлесуін қамтамассыз ете алады.
Ферменттердің суббірліктік құрылымының ерекшеліктері.
Полиферменттер және изоферменттер.
Фермент молекуласының кеңістіктегі өлшемдері әртүрлі және субстратпен салыстырғанда үлкен болады. Көптеген ферменттер молекулалық массасы өте үлкен бірнеше суббірліктерден тұратын белок-мультиэнзимдерден (полифермент) құралған болады. Мысалы, глутаматдегидрогеназа молекуласы алты суббірліктен (әрбірінің м. м. = 12 кДа), тұрады, ал олардың өздері ферменттің толық молекуласы (м. м. = 1млн Да) төрт фрагменттен (әрбірі м. м. = 250 кДа) құралған. Уреаза ферменті сегіз суббірліктен (әрбірінің м. м. = 60 кДа) тұрады. Суббірліктердің (протомер) мультимерлердегі (мультиэнзим) бір бірімен байланысуы әртүрлі.
 Полифермент молекуласы екі түрлі бір бірінен ү.р.қ. немесе т.р.қ. ғана кейбір кішкене өзгерістері бар А типті және Б типті суббірліктен құрастырылған.
Полифермент молекуласы екі түрлі бір бірінен ү.р.қ. немесе т.р.қ. ғана кейбір кішкене өзгерістері бар А типті және Б типті суббірліктен құрастырылған.
Суббірліктерге диссоциациялану фермент активтілігімен бірге әсер ету ерекшеліктерін де тежеуі мүмкін. Бұл жағдайда бір суббірлік аллостерлік реттегіш ретінде келесі суббірлікке әсер етеді. Суббірліктердің ферменттік әсерлері бір біріне жегілген тәріздес өтеді деп қабылданған. Сондықтан реакцияның энергиялық тиімсіз стадиясы келесі суббірліктен бөлінген энергияға жегілген болады. Торшаларда өтетін ферментативтік реакциялар көптеген ферменттердің (әртүрлі) бірлесіп әсер етуі арқылы өтеді. Бұл жүйелерді бірнеше ферменттерден тұратын комплекс деп қарастыруға болады. Пирожүзім қышкылының дегидрогеназасы әртүрлі коферменттермен (тиаминпирофосфат, ФАД, липой қышқылы, НАД, КоА) байланысқан үш белок-ферменттен тұратын полиферменттік комплекс (м.м. ≈ 4,500 кДа). Полиферменттік комплекстер торша мембранасы немесе органелласымен байланысқан болады. Сондықтан, тыныс алу тізбегі жүйесінің ферменттерінің (олар сутегі мен электронды субстраттан оттегіге тасымалдайды) бір бөлігі митохондрияның ішкі мембранасында орналасқан болады. Ферменттердің орналасуы реті белгілі тәртіп бойынша реакцияның жүру және кезектесу бағыты бойынша орналасады. Тотығу-тотықсыздану реакцияларының, ҮКҚ циклі ферменттері-митохондрияда, белок биосинтезі ферменттері-рибосома мен гиалоплазмазада (АҚ активтеуші), нуклеин қышқылы ферменттері-ядрода шоғырланған болады.
Полиферменттік жүйелердің ұйымдасуы. Ферменттік катализдің заттардың өзгертуімен өтетін биохимиялық реакциялар жиынын бір процесс ретінде өткізеді. Торшаның, ұлпалардың мүшелердің ағзаның өмір сүріне қажетті заттарды осы жолдармен қамтамассыз етеді.
Полиферменттік жүйелердің құрылысы келесі жолдармен құралады:
— 1. қызметтік құрылым бойынша ұйымдасқан. Бұл жағдайда әртүрлі типтегі ферменттер катализдік процесстің жүру барысында ерітіндіде бір бөлікте болады;
— 2. құрылымдық ұқсастығы бойынша ұйымдасқан. Ұқсас құрылымдағы белоктар бір бірімен өзара әсерлесіп ферменттердің құрылымдық жүйесін құрайды;
— 3. аралас типті құрылымдар бойынша ұйымдасқан. Екі типтегі құрылым (А және Б типтері) әртүрлі комбинацияларда құралады.
Полиферменттік жүйеде алғашқы фермент катализдеген реакция өнімі келесі фермент үшін субстрат болады. Бұл процесс полифермент жүйесіндегі әрбір фермент толық әсерлесуі өткенше жалғасады.
Изоферменттер (изоэнзим, изозим) — мультимердегі А және Б типтегі суббірліктердің әртүрлі комбинациясының нәтижесінде пайда болған изомерлер. Мысалы, А және Б типтегі протомерден 5 изомер (АААА; АААБ; ААББ; АБББ; ББББ) алуға болады.
Қазіргі кезде сүт қышқылының (лактат) пирожүзім қышқылына айналуына немесе кері бағытта катализдейтін лактатдегидрогеназа ферменті жақсы зерттелген. Лактатдегидрогеназа әртүрлі гендермен кодталған Н (ағылш. heart — жүрек) және М (ағылш. muscle — бұлшық ет) типтеріндегі жүрек пен бұлшықеттерде басым болатын суббірліктерден құралған. ЛДГ1 — (НННН), ЛДГ2 — (НННМ), ЛДГ3 — (ННММ), ЛДГ4 — (НМММ), ЛДГ5 — (ММММ) изомерлері физико-химиялық қасиеттері бойынша (м. м., электрофореттік қозғалысы, изоэлектрлік нүктесі, аминоқышқылдық құрамы мен кезектесуі реті, ұлпаларда, мүшелерде шоғырлануы) ерекшеленеді. Мысалы, ЛДГ1, ЛДГ2 — анодқа жылжиды (анодтық фракция) аэробтық процесстерге қатысады, ЛДГ4, ЛДГ5 — катодқа жылжиды (катодтық фракция) анаэробтық процесстерге қатысады. ЛДГ1, ЛДГ2 — жүрек бұлшықеті, бүйректе, мида және эритроциттерде басым болса, ЛДГ4, ЛДГ5 — қаңқа бұлшық еттері, бауыр, өкпеде, ЛДГ3 — көк бауырда кейбір эндокриндік бердерде кездеседі.
Иммобилденген ферменттер. Соңғы кездері медицина, фармация салаларында жасанды иммобилденген ферменттер кең қолданылады. Ферменттерді әртүрлі материалдарға (полиакриламид, шыны, силастик, полистерол) бекітіп иммобилдеу (байланыстыру) арқылы ерімейтін жасанды катализатор жасағанда ферменттер активтілігін сақтап, сонымен бірге, олардың әсерінің ұзақтығын, мықтылығын, тұрақтылығын арттырады. Бұл технология қазіргі кезде өндірісте, тұрмыста кең қолданылуда.
Әртүрлі субторшалы құрылымдардың ферменттік құрамы. Ферменттер торшада және оның органеллаларында атқаратын қызметі, реакциясына сәйкес түрде жинақталғаны себепті компартменттерге бөлінеді, ол жалпы түрде компартментализация деп аталады.
Ферменттердің компартменттігі келесі түрде беріледі:
— торшаның ядросының ферменттері: НАД-пирофосфорилаза, ДНК-полимераза, РНК-полимераза, оротидилатпирофосфорилаза, уридинкиназа, 5'-нуклеотидаза, УДФ-глюкозопирофосфорилаза, гликолиз ферменттері, аминоқышқылдарды активтеуші ферменттер, аминоқышқылдар трансферазасы, аденозиндезаминаза, лейцинаминопептидаза, уроканиназа. Барлығы 13 фермент.
— ядро қабығының ферменттері: цитохромоксидаза, глутаматдегидрогеназа, НАД·Н-цитохром-с-редуктаза, арилсульфатаза А және Б, АТФ-аза (Mg2+), ацетилэстераза, метилбутириназа. Барлығы 8 фермент.
— митохондрия ферменттері: АТФ-аза (Mg2+, Na+, K+, Ca2+), сукцинатдегидрогеназа, цитохромоксидаза, β-оксибутиратдегидрогеназа, α-глицерофосфатдегидрогеназа, ацил-КоА-β-дегидрогеназа, НАД·Н-дегидрогеназа, май қышқылын тотықтырушы ферменттер, май қышқылдарын синтездеуші ферменттер, Кребс циклінің 5 ферменті, миокиназа, моноаминоксидаза, α-кетоглутаратдегидрогеназа, сукцинатцитохром–С-редуктаза, аспартатаминотрансфераза, орнитинкарбомоилтрансфераза, НАД·Н-цитохром-В5-редуктаза, НАД·Н-оксидаза, пируватдегидрогеназа, пролиноксидаза, липоамиддегидрогеназа, кинуренингироксилаза, аденилаткиназа, нуклеозиддифосфокиназа. Барлығы 28 фермент.
— лизосома ферменттері: барлығы 35 фермент — катепсиндер, коллагеназалар, β-галактозидазалар, β-глюкоуронидазалар, гиалуронидаза, лизоцим, нейраминидазалар, ДНК-аза және РНК-аза, қышқылдық фосфатаза, фосфолипазалар, қышқылдық пирофосфотаза және қышқылдық АТФ-аза.
— пероксисома ферменттері: каталаза, пероксидаза, уратоксидаза, D-, L- аминоқышқылдарының оксидазалары.
— эндоплазмалық ретикулум ферменттері: НАД·Н-цитохром-с-редуктаза, глюкозо-6-фосфатаза, нуклеотидтерінің дифосфатазасы, сілтілік фосфатаза, 5'-нуклеотидаза. Барлығы 20 фермент.
— гиалоплазма ферменттері: гликолиз ферменттері, аденозиндезаминаза, гексозодифосфатаза, лактатдегидрогеназа, изоцитратдегидрогеназа, глутатионредуктаза, аспартатаминотрансфераза, аланинаминотрансфераза, глюкокиназа, глюконфосфорилаза, альдолаза, аконитаза. Барлығы 18 фермент.
Ферменттерді бөліп алу.Ұлпаларда ферменттер өте аз мөлшерде кездеседі. Ферменттерді бөліп алу үшін әртүрлі әдістерді қолданады. Көптеген ферменттерді адам мен жануарлардың асқорыту сөлдерінен алады (ол ферменттердің концентратты сулы ерттіндісі). Ұлпаларды суықта ыдырату (ұсақтау, кварц, құмдарымен үйкелеу, гомогендеу) арқылы экстракциялап (спирт, тұзды ерітінді және т.б.) ферменттерді бөледі. Адсорбция (Данилевский) тәсілі, ионалмасу хроматографиясы, центрифугалау, электрофорез әдістерін кең қолданады.
Фермент активтілігін анықтау. Бөліп алынған ферменттердің тазалығы оның активтілігі арқылы бағаланады. Егер фермент активтілігі ары қарай тазартқанда өзгермейтін болса, оны гомогенді таза фермент ретінде қабылдайды. Ферменттерді биологиялық материалдардан бөліп алу қиындық туғызады. Сондықтан ферменттің сандық мөлшерін оның субстратқа әсер еткендегі активтілігі арқылы жанама түрде анықтайды.
Химиялық реакцияның жылдамдығы фермент активтілігіне тығыз байланысты немесе тәуелді болады. Сол себептен ферменттің сандық мөлшерін екі түрлі жолмен келесі тендеулер арқылы анықтауға болады:
1. Фермент әсер ететін субстраттың, белгілі бір сандық мөлшерінің белгілі бір уақытта азаюы арқылы;
K = ΔS / Δt,
K — реакция жылдымдығының тұрақтысы, ΔS — субстрат мөлшері, Δt — уақыт өлшемі.
2. Реакция өнімінің мөлшерінің белгілі бір уақыт өлшемінде көбеюі арқылы
K = ΔP / Δt,
ΔP — реакция өнімі.
Бұл екеуі де абсолютті теңдей шамалар. Себебі неше субстрат реакцияға түссе сонша реакция өнімі түзіледі (массалардың сақталу заңы бойынша). Сондықтан кезкелгенін пайдалануға болады.
Фермент активтілігіне бірнеше факторлар әсер етеді. Оларды жалпы түрде үш топқа бөледі:
1. Торшадағы фермент мөлшерлері немесе оның биосинтезінің деңгейіне тәуелділік;
2. Ферментативті реакциялардың жылдамдығына әсер етуші факторларға қатысты тәуелділік — субстраттың бар болуы, апофермент конформациясына әсер етуші активатор, ингибитор, кофакторлардың, денатурлаушы әсерлердің, температура, гидратация, рН, электролиттердің болғандығы;
3. Ферменттердің шоғырлануы, мембрана өткізгіштігі, субстраттың фермент әсеріне ыңғайлылығы, реакция өнімдерінің әкетілу жылдамдығына байланысты тәуелділік.
Фермент активтілігінің өлшем бірлігі. Халықаралық биохимиялық одақтың ферменттер бойынша комиссиясы 1962 ж. ферменттер мөлшерінің мәндерінің шамаларын көрсететін жалпы ережені ұсынды. Бұл ереже бойынша ферменттердің өзіндік активтілігі (Е) ретінде оның (Т = 25° С) 1 минутта субстраттың 1 микромолін катализдеуге (немесе 1 микромоль реакция өніміне айналуы) кеткен мәні алынады.
1 ХБ = 1 мкмоль/мин
ХБ — халықаралық бірлік (орыс тілінде МЕ-международная единица).
Сонымен бірге СИ жүйесінде фермент активтілігін — катал бірлігі бойынша өлшеу қабылданған. Катал бұл 1 моль субстратты (немесе 1 моль реакция өнімі түзілуін) 1 секундта катализдеуге кеткен фермент активтілігінің мәні
1 катал = 1 моль/с
Клиникалық биохимиялық зерттеулерде фермент активтілігіне әсер ететін биологиялық сұйықтықтың көлеміне (V) қатысты каталдың литрге қатынасы (катал/литр) алынады.
Фермент активтілігін анықтаудың қазіргі заманғы әдістеріне спектрофотометрлік, флюориметрлік, полярографикалық, колориметрлік және т. б. тәсілдер жатқызылады.
Ферменттердің әсер ету механизмдері.
Ферменттік катализдің теориялық негіздері.
Ферменттер басқа да катализаторлар (бейорганикалық) тәрізді термодинамикалық тұрғыдан жүруі мүмкін емес реакцияны жүргізбейді. Тек, жүре алатын реакцияның жылдамдығын ғана жоғарлатады. Кез келген химиялық реакцияның жүру мүмкіндігі оның реакция өнімдерінің энергиясының реакцияласушы заттардың энергиясынан төмен немесе бірдей болғанында ғана өтеді. Реакция қашанда бос энергияның төмендеуі бағытына қарай жүреді, сондықтан реакция тепе-теңдігі өнімдер түзілуіне сәйкес ығысады. Бірақ, кез келген реакция басталуы үшін оның кедергі энергиясын, активтеуші энергияны қосу арқылы жеңуі қажет. Себебі реакция жүргенде кедергі энергиясының энергиялық қоры артық аздаған молекулалар ғана әсерлеседі. Бұл жағдайда реакция жылдамдығы да баяу болады.
 Реакцияласушы заттардың көптеген молекулалары бір бірімен неғұрлым жиірек әсерлесетін болса ғана жылдамдық жоғарлауы мүмкін. Ол тек активтеуші энергия көмегімен активтелген молекулалар мөлшерінің көбеюі нәтижесінде бола алады.
Реакцияласушы заттардың көптеген молекулалары бір бірімен неғұрлым жиірек әсерлесетін болса ғана жылдамдық жоғарлауы мүмкін. Ол тек активтеуші энергия көмегімен активтелген молекулалар мөлшерінің көбеюі нәтижесінде бола алады.
Екі заттың реакциясын байқағанда
АВ + CD ↔ AD + BC
реакция өнімдері (AD, BC) түзілуі үшін АВ және CD әсерлесуіне қажет а-ға тең (активтендіруші энергия) энергияны қосымша алуы қажет. Ал реакция кері бағытта жүретін болуы үшін б-ға тең шамадағы көп мөлшерде энергия қажет. Сол себепті кері бағытта жүретін реакцияның активтендіруші энергиясы (Еа) жоғары болады. Бұл жағдайда екі реакция үшін де бірдей өзгеретін бос энергияның шамасын в-кесіндісі көрсетеді. Солдан оңға қарай өтетін реакция экзотермиялық, ал кері бағыттағы реакция эндотермиялық болады. Сондықтан реакцияларды эндергоникалық (энергияны қабылдап жүретін реакция) және экзергоникалық (энергия бөліп жүретін реакция) реакцияларға бөледі. Реакция жүргенде энергияның жылу түрінде бөлінуі немесе қосып алуы міндетті емес.
Реакция жылдамдығының жоғарлауы катализатордың Еа-ны (кедері энергиясын) төмендетуі арқылы өтеді. Ол суретте үзікті сызықпен көрсетілген. Мысалы, сутегі асқын тотығын (Н2О2) сутегі мен оттегіге бөлу үшін (Н2О2 → Н2↑ + О2↑) Еа = 75,2 кДж/моль қажет. Коллоидтық пласты катализатор ретінде қолданғанда Еа = 50,2 кДж/моль, ал биокатализатор каталаза қатысқанда Еа = 8,3 кДж/моль қажет болады.
Биокатализатор-ферменттің жылдамдығын жоғарлатуы немесе Еа-ны төмендеуі көп этапты механизм арқылы іске асады.

Сур. 6. Фермент пен субстраттың әсерлесу механизмі (Михаэлис-Ментен).
Ферментативті реакцияның жүруін жалпы түрде үш этапқа бөледі.

немесе фермент + субстрат ↔ фермент-субстраттық комплекс →
→ өнім + фермент.
Бұл реакция теңдеуінде (Михаэлис-Ментен теңдеуі) шешуші рольді фермент пен субстраттың қосылуынан түзілген фермент-субстраттық комплекс атқарады. Ферменттің әсерлесу спецификасына тәуелді өтетін бұл қосылыс белгілі бір байланыстардың әлсізденіп бір мезгілде субстрат активтелінуі мен реакцияласушы қабілетінің жоғарлауына әкеледі. Фермент-субстраттық комплексте бір мезгілде екі процесс өтеді: алғашқыда, комплекстің электрондар тығыздығының өзгеруі нәтижесінде ондағы байланыстардың полярлануы және соңынан субстрат молекуласындағы және активтік орталықтағы кейбір байланыстардың геометриялық деформациясы. Молекулалардағы химиялық байланыстардың деформациясы мен полярлануы фермент-субстрат комлексінің аралық қалпындағы кедергіні (активтеуші энергияны (Еа)) жеңуді қамтамассыз етеді. Ферментативтік катализдің бірінші этапында фермент пен субстраттың бір бірмен ковалентті немесе басқа түрлі байланысуы өтеді. Екінші этапта субстрат оған байланысқан ферменттің әсерінен химиялық өзгерістерге түседі. Соның нәтижесінде фермент-өнім комплексі пайда болады. Үшінші этапта фермент-өнім комплексі бөлініп фермент және өнімге ажыратылады. (Осы тараудағы активтік, жанастырушы, аллостерлік оралықтар тақырыбын қараңыз).
Қысқа уақытта «өмір сүріп», жылдам арада құрам бөліктеріне ажырайтын фермент-субстрат комплексі туралы түсінік 1913 ж. Михаэлис пен оның шәкірті Ментеннің ферментативті реакциялардың кинетикасына анализ жасауы нәтижесінде дамытылды және кейін Михаэлис-Ментен теориясы деп аталды. Бұл теория бойынша жоғарыда келтірілген схема ферментаттік процесстің үдеуі, энергетикалық тұрғыдан, реакцияның кедергі энергиясын тұрақсыз фермент-субстрат комплексі түзілуі көмегімен «айналып» өтуі арқылы іске асады. Комплекстің түзілуінде және ыдырауында аралық реакциялардың энергиясын негізгі реакцияға қарағанда төмендеу кедергілік энергияда болады.
Қайтымды реакция жүргенде ферментпен (Е) субстрат (S) (реакциялар жылдамдығы тұрақтысы k1 және k2) комплекс (ES) түзеді. Комплекс (ES) фермент пен өнімге реакция жылдамдығы тұрақтысы kS бойынша ыдырайды. Комплекс (ES) диссоциациалануы мүмкін болғандықтан оның диссоциация тұрақтысы (kS = k2 / k1) теңдеуі бойынша есептеледі. Егер комплекстің диссоциация тұрақтысы жоғары болса қайтымды реакцияның k2-сінің мәні де жоғары, ал k1 мәні төмен болады. Сондықтан комплекс алғашқы қосылыстарға жеңіл бөлінеді де реакция баяу жүреді. Егер, керісінше k1 мәні жоғары болса, kS пен k2 мәңдері төмен сол себепті кері бағыттағы реакцияның жүруі бәсеңдейді, диссоциация төмендейді, ал ферменттік реакция тікелей бағытта жылдам жүреді.
Массалардың әсерлесу заңы бойынша теңдеуді келесі түрде жазуға болады:
[S] · ([E0] − [ES]) = kS · [E·S]
[E0] — реакция басталардағы ферменттің жалпы концентрациясы, [ES] — фермент-субстрат комплексі концентрациясы. [E0] − [ES] — бастапқы фермент концентрациясынан фермент-субстрат комплексі концентрациясын алғандағы фермент концентрациясы.
Теңдеуді ары қарай ықшамдағанда, келесі түрге келеді:
 .
.
Келтірілген теңдеуге сәйкес, егер [ES] концентрациясы неғұрлым көп болса ферменттік реакция жылдамдығы да жоғары болады. Ал, жылдамдық максимумы тек [ES] концентрациясы фермент концентрациясына теңескенде ғана немесе [ES] = [E0] барлық фермент фермент-субстрат қосылысына түзілгенде жетеді. Реакция жылдамдығының максимумдық жылдамдыққа қатынасы келесі түрде беріледі:
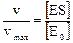
Бұл теңдеуді жоғарыда келтірілген теңдеумен қосып ықшамдап келесі өрнекті алуға болады:
 немесе
немесе 
 Теңдеу Михаэлис-Ментен теңдеуі деп аталады.
Теңдеу Михаэлис-Ментен теңдеуі деп аталады.
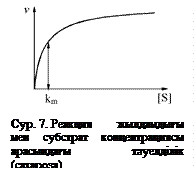
Теңдеудің шешімі келесі жағдайды түсіндіре алады. Егер [S] мәні KS-ке қарағанда үлкен болса (сахарозаны β-фруктофуранозидазамен гидролиздегенде KS = 0,0167 М) реакция жылдамдығы жылдамдық максимуміне тең болады (v = vmax).
Михаэлис-Ментен реакция жылдамдылығы мен субстрат концентрациясы арасындағы тәуелділікті β-фруктофуранозидаза әсерінен сахароза, глюкоза, фруктоза ыдырауларын (сур.7) график түрінде көрсетті. Суреттегі қисық сызық бойынша реакция алғашқыда нольдік ретте жүрсе, соңынан бірінші ретпен жүретіндігі байқалады.
Соның негізінде ферменттік реакцияның толық жалпы жылдамдығын келесі теңдеу арқылы есептеуге болады.
v = Km · [ES], Km — Михаэлис тұрақтысы (Km = K3 / K4).
Михаэлис тұрақтысының өлшем бірлігі моль/л тең. Егер реакция жылдамдығы жылдамдық максимумының жартысына тең болса (v = ½vmax) Михаэлис тұрақтысы субстрат концентрациясына тең болады (Km = [S]). Михаэлис тұрақтысы (Km) қашанда диссоциация тұрақтысынан (KS) бірнеше есе жоғары болады (мысалы, алкогольдегидрогеназаның KS = 10−7 моль/л, ал Km = 10-3 моль/л). Сондықтан, ферментативті реакциялардың жылдамдығы басқа реакцияларға қарағанда өте жоғары, себебі, көптеген заттар үшін KS = 10-2—10-7 аралығында болады. Михаэлис-Ментен теңдеуін ары қарай Лайнуивер мен Берк, Холдейн-Бриггс дамытты.
Ферменттердің әсерлесуінің ерекшеліктері. Ферменттердің бейорганикалық катализаторлардан өзгешелігі олардың өте нәзік мамандандырылған әсер ету ерекшелігіне қабілеттілігі. Олар қатаң түрде белгілі бір реакцияларды катализдейді. Тек осы қасиеті арқылы ғана жекеленген ферменттік реакциялардың бір бірмен тығыз байланысты болуы және қатаң түрде реттеліп жүруі сақталады. Бұл тірі торшалар мен ағзалардың өмір сүруі үшін қажетті, заттар алмасуларына қажетті әртүрлі биохимиялық реакциялардың бірігуі болып табылады.
 Ферменттік реакция жүруі үшін фермент субстратқа әсер етуі қажет. Бұл тек фермент молекуласындағы активті орталықтың құрылымына жанасу, каталиттік орталықтың, ғана емес сонымен бірге субстраттың да химиялық құрылысының ерекшеліктеріне байланысты болады. Фермент пен субстрат бір біріне сәйкес келуі қажет, немесе фермент өзі әсер ететін субстратты танып біледі. Бұл үшін фермент құрылымындағы жанастырушы орталықтың қызметі ерекше. Жанастырушы орталықтың көмегімен реакцияласушы зат-фермент-субстрат комплексі түзіледі.
Ферменттік реакция жүруі үшін фермент субстратқа әсер етуі қажет. Бұл тек фермент молекуласындағы активті орталықтың құрылымына жанасу, каталиттік орталықтың, ғана емес сонымен бірге субстраттың да химиялық құрылысының ерекшеліктеріне байланысты болады. Фермент пен субстрат бір біріне сәйкес келуі қажет, немесе фермент өзі әсер ететін субстратты танып біледі. Бұл үшін фермент құрылымындағы жанастырушы орталықтың қызметі ерекше. Жанастырушы орталықтың көмегімен реакцияласушы зат-фермент-субстрат комплексі түзіледі.
Қазіргі кезде фермент пен субстраттың әсерлесу ерекшелігінің механизміне екі гипотеза (Фишер және Кошленд) ұсынылған.
Фишердің гипотезасы бойынша, фермент өзі әсер ететін субстратқа кілттің құлыпқа сәйкес келуіндей жанасады. Әртүрлі гликозидтерді ферменттермен гидролиздеуді зерттеген жұмысында Э.Фишер «…химиялық әсерлесу атқарылуы үшін энзим мен глюкозид бірі біріне кілттің құрыпқа келгеніндей дәл келуі қажет» деп жазған.
Ол фермент геометриялық және химиялық тұрғыдан өте қатаң, тұрақты құрылымда болады деп қабылдаған. Бұл құрылымның сәл де болса өзгеруі кілттің өзгеруі тәрізді құлыпқа сәйкес келмей қалады.
Соңғы кездері қатаң немесе тұрақты мықты құрылымға қарама қарсы майысқақ, созылмалы құрылым туралы гипотеза (американдық ғалым Д.Кошленд) ұсынылды.
Кошленд гипотезасы бойынша, фермент молекуласының конформациясы жане оның активтік орталығы коэнзим мен субстрат әсерлесуіне байланысты өзгереді. Суретте жоғарғы бөлікте, субстрат молекуласына сәйкес бейімделіп фермент конформациясы өзгереді, активті орталықтағы қызметші топтар да сәйкестеніп жанасады. Сондықтан реакция өтеді.
Төменгі бөлікте, субстраттың геометриялық өлшемдері өте кіші болғандықтан ферменттің қызметші топтары сәйкес келмегендіктен реакция жүрмейді. Кошленд гипотезасы бойынша фермент конформациясының өзгеруіне байланысты, оның физика-химиялық қасиеттерінің де өзгеретіні эксперимент жүзінде бірнеше рет дәлелденді. Бауырдың алкогольдегидрогеназасы температура әсерінен жылдам денатурланады және инактивтеледі. Ал оның НАД+ немесе НАД·Н-пен, немесе олардың бәсекелесі (конкуренті) изомай қышқылының амиді (ИМҚА)-мен комплексі, немесе НАД·Н-ИМҚА комплексі белгілі жағдайда қыздырғанда денатурацияны тежейтіндігі байқалған. Бұл жұмыстар г.Теорель зерттеулерінде дәлелденді. Аталған қасиеттер химотрипсин ферментінде де байқалады.
Субстраттық әсерлесу ерекшеліктері. Субстраттық (талғамдылық) әсерлесу ерекшелігі — бұл фермент молекуласының бір субстратқа немесе химиялық байланыстары мен топтары ұқсас бірнеше субстраттар топтарына әсері етуі қабілеті. Ферменттердің субстраттық әсерлесу ерекшелігі (талғамдылығы) оның активті орталығының субстратпен комплементарлы болып келуіне тәуелді болады. Субстраттық талғамдылықты шартты түрде үш түрге бөледі:
1. Абсолюттік субстраттық әсерлесу ерекшелігі (талғамдылық) -бұл ферметтің тек белгілі бір ғана субстратқа әсер ету қабілеті. Мысалы, уреаза ферменті тек мочевинаның гидролиттік ыдырау реакциясын катализдейді, ал ұқсас құрылыстағы метилмочевинаға әсер етпейді:

Глюкокиназа ферменті гликолиттік ыдырау реакциясында тек глюкозаға әсер етеді.

2. Субстраттық стереохимиялық әсерлесу ерекшелігі (талғамдылық) — бұл ферменттің тек бір ғана оптикалық (D немесе L), немесе, геометриялық (цис-, немесе тране-) изомерге әсер ету қабілеті. Мысалы, протеолиттік ферменттердің тек L-аминқышқылдардан түзілген пептидтерге әсер етуі немесе L-аминооксидаза мен D-аминооксидазаның әсер етуі, лактатдегидрогеназаның тек L-сүт қышқылына әсер етіп, D-сүт қышқылына әсер етпеуі жатқызылады.
3. Субстраттық салыстырмалы әсерлесу ерекшелігі (талғамдылық) - бұл ферменттің белгілі бір типтегі химиялық байланысы бар субстраттар топтарына әсер ету қабілеті. Мысалы, асқазан-ішек трактісі (АІТ) протеиназаларының әртүрлі белоктардың пептидтік байланыстарын ыдыратуы. Пепсин ферменті тирозин мен фенилаланиннің амин топтарымен түзілген пептидтік байланыстың үзілуін катализдейді. Жылу қанды жануарлардың асқазанының шырынынан алынған (шошқа, бұқа, қой) пепсиндерінің әсерлері ұқсас, ал балық пепсині біршама өзгешелеу ерекшелік көрсететіні байқалған. Трипсин ферментінің ароматты аминоқышқылдармен түзілген пептидтік байланыстарды үзуі (карбоксилдік топтары жақын орналасқан).
Кейбір оксиредуктазалар электрон акцепторы ретінде екі кофакторды да НАД+, НАДФ+ қолданады. Бірақ, сүтқоректілердің май қышқылдарын немесе стероидтардың синтезін катализдейтін оксиредуктазалары тотықсыздандырғыш ретінде НАДФ·Н-ты, гликолиз, май қышқылдарының тотығуын катализдейтін немесе ыдырату процесстеріне қатысатын ферменттер тотықтырғыш ретінде НАД+-ті жиірек қолданатыны байқалған.
Ферменттік әсерлесу ерекшелігі. Ферменттердің әсеріндегі талғамдылығы — бұл бір субстратқа әртүрлі ферменттердің әсер етіп әртүрлі тек өзіне ғана тән реакцияларды катализдеуге қабілеттілігі.

| E1, E2, E3 — ферменттер P1, P2, P3 — өнімдер S — субстрат |
Ферменттер (Е1, Е2, Е3) тек өздеріне ғана тән әсерлесу талғамдылығына қабілетті және олар бір ғана субстратқа (S) әсер етеді. Бірақ әрбір фермент тек бір ғана типтегі реакцияны жүртізеді. Бұл талғамдылықтың ерекшелігі фермент молекуласының каталиттік орталығындағы реакцияласушы топтардың қасиетіне (жай ферменттерде) және кофакторлардың химиялық қасиеттеріне (күрделі ферменттер) тығыз байланыстылығында.
Ферменттік реакциялардың реттелуі.
Тірі ағзаларда өтетін биохимиялық ферменттік реакциялардың реттелуі қоршаған орта факторларына тәуелді өтеді. Бұл ағзалардың қоршаған ортаның климаттық жағдайларына байланысты бейімделуінің (адаптация) негізіне жатады. Бірақ, бұл бейімделуге барлық ферменттер емес тек реттелуші ферменттер ғана ықпал ете алады. Себебі бұл ферменттердің активтілігі ортаның әртүрлі факторларына (рН, Т, қысым, [S] және т.б.) тәуелді болады. Ферменттердің бұл қасиеті биосфераның типтерінің жер шарының климаттық белдеулеріне сәйкес таралып орналасуына, биологиялық типтердің эволюциялық өзгерістеріне әкеліп, жаңа күшті түрлердің пайда болуына ықпал етеді. Реттелуші ферменттер реакциялардың реттелу жолдарының механизмдері мен принциптерінің негізгі объектілері болып табылады.
Ферменттік реакциялардың реттелуінің жалпы принциптері. Кез келген ағзалар (бір торшалы немесе көп торшалы) эволюция процессінде қалыптасқан қоршаған ортаның әсеріне бейімделген өзіне ғана тән зат алмасуларымен сипатталады. Өзіне тән алмасуы сол ағзаның генетикалық табиғатына байланысты түзілетін мамандандырылған ферменттер жиынының қасиеттерімен сипатталады. Тірі ағзалардың керемет қасиеттеріне оның қоршаған орта өзгерулеріне сәйкес заттар алмасуларын өздігінен реттеу қабілеті жатады. Өздігінен реттелуді үш жолмен — субстраттар мөлшері, ферменттер мөлшері (фермент синтезін реттеу), фермент активтілігін реттеу арқылы атқарылады және олардың шоғырлануына (локализация) байланысты болады.
Торшаларда өтетін биохимиялық реакциялардың реттелуі әртүрлі атқарылады. Соның ішінде субстрат пен фермент қатысуындағы реакциялардың реттелуі келесі жолдар субстрат мөлшері, фермент мөлшері және фермент активтілігін реттеу арқылы іске асады.
Субстраттың сандық мөлшері арқылы реттелу. Бұл кез келген ферменттік биохимиялық реакция жылдамдығы сол реакцияға қатысатын заттардың мөлшерлеріне байланыстылығын көрсетеді. Реакция жылдамдығы фермент активтілігінің шамасына тең және субстраттың сандық мөлшері мен реакция жылдамдығы арасында тығыз тәуелділік бар.
 Бұл тәуелдікті график түрінде бейнелейтін болсақ, алғашқыда реакция жылдамдығының белгілі бір субстрат концентрациясына дейін жоғарлауын (а-кесіңдісі) байқаймыз. Ары қарай жылдамдық өсуі тежеліп бір қалыпты өтеді (b-кесіңдісі) реакция соңында төмендейді.
Бұл тәуелдікті график түрінде бейнелейтін болсақ, алғашқыда реакция жылдамдығының белгілі бір субстрат концентрациясына дейін жоғарлауын (а-кесіңдісі) байқаймыз. Ары қарай жылдамдық өсуі тежеліп бір қалыпты өтеді (b-кесіңдісі) реакция соңында төмендейді.
Реакцияласушы қоспада, бастапқы жағдайда субстрат мөлшері өте жоғары болады. Сондықтан бос фермент молекуласына келетін субстрат көп болады және олардың «соқтығысу дәрежесі» өте жоғары. Осы жағдайдың себебінен реакция жылдамдығы күрт жоғарлайды. Белгілі бір уақыттан кейін жылдамдықтың үдеуі төмендеп белгілі бір деңгейде өтеді. Бұл реакцияласушы қоспадағы фермент пен субстрат мөлшерлерінің қатынасы бір біріне шамалас болғандығын байқатады (қоспадағы ішкі және сыртқы факторлар әсерін есепке алмағанда). Реакция соңында субстрат мөлшерінің азаюы фермент активтілігі сақталса да реакция жылдамдығының төмендеуіне әкеледі.
Тірі торшалардан субстраттардың сандық мөлшері көптеген факторларға тәуелді. Бұл шексіз шамада болмайды, торшаның сол немесе басқа субстрат үшін болатын белгілі бір физиологиялық диапазонына тікелей байланысты болады.
Көптеген биохимиялық реакциялар торша цитоплазмасында жүрсе, кейбірі митохондрияда, ал бір бөлігі рибосома мен ядрода өтеді. Сондықтан, реакция жүретін орындарға субстраттың әкеліну жылдамдығы оның сандық мөлшерін айқындайды. Ал, бұл жағдай торша органеллаларын қоршап тұратын мембрананың субстрат үшін өткізгіштік қасиетіне тығыз байланысты.
Кейбір реакциялар үшін субстрат басқа реакцияның өнімі болып табылады. Ал оның мөлшері сол реакцияның жүру жылдамдығына тәуелді. Сондықтан бұл реакциялардағы субстраттың сандық мөлшері субстрат болатын өнімнің синтезделу жылдамдығына тығыз байланысты. Көптеген ферменттер үшін бір ғана субстрат реагент бола алады. Бұл белгілі бір реакция үшін субстрат мөлшерінің азаюына әкелуі мүмкін. Себебі бұл субстратқа әсер ететін басқада ферменттердің де болып субстратқа таласуынан туындайды. Нәтижесінде субстраттың сандық мөлшері бәсекелес (конкурентті) реакциялардың жүруі барысына тәуелді болады.
Ферменттің сандық мөлшері арқылы реттелу. Субсреакциялардың жүруі барысына тәуелді болады.
Ферменттің сандық мөлшері арқылы реттелу. Субстрат мөлшері тәріздес ферменттің сандық мөлшері мен ферменттік реакцияның жылдамдығы арасында сызықты тәуелділіктің болатыны байқалады.
 Физиологиялық диапазонда ферменттің сандық мөлшері оның келесі маңызды көрсеткішіне тәуелді. Бұл ферменттің синтезделу жылдамдығы мен оның интенсивті ыдырауының арақатынасы арқылы анықталады. Өз кезегінде фермент синтезінің жылдамдығы индукция мен репрессия (басу, тежеу) процесстеріне тығыз байланысты (фермент биосинтезі тақырыбын қараңыз).
Физиологиялық диапазонда ферменттің сандық мөлшері оның келесі маңызды көрсеткішіне тәуелді. Бұл ферменттің синтезделу жылдамдығы мен оның интенсивті ыдырауының арақатынасы арқылы анықталады. Өз кезегінде фермент синтезінің жылдамдығы индукция мен репрессия (басу, тежеу) процесстеріне тығыз байланысты (фермент биосинтезі тақырыбын қараңыз).
Фермент молекуласының ыдырауы ұлпалық протеиназалардың әсерінен атқарылады. Бұл аутолиз процессі нәтижесінде өтеді және ол лизосомаларда интенсивті жүреді.
Ферменттердің биосинтезінің реттелуі. Тірі торшаларда ферменттердің түзілуі энзимологияның маңызды проблемарының біріне жатады. Ұлпаларда белоктардың тұрақты түрде жаңалануы (Р.Шёнгеймер изотоптық әдіс арқылы зерттеген) жүреді. Бұл процесстің жылдамдығы ұлпаның жасына, физиологиялық қалпына, қасиетіне байланысты. Мамандандырылған ұлпаларда, мысалы, асқорыту бездерінде асқорыту трактісіне бөлінетін тағамдық белок-ферменттердің синтезі күшті жүреді. Ферменттер синтезі жас, өсіп келе жатқан ұлпаларда, дамушы өскіндерде (жануарлар мен өсімдіктің мен микроағзалардың дамушы спораларына ұқсас), интенсивті өтеді.
Ағзада түзілетін ферменттер жиыны, табиғаты оның генетикалық факторлары бойынша айқындалады. Соңғы кездердегі биохимия мен биохимиялық генетиканың эксперименттерінің нәтижелері оны толық дәлелдейді. Классикалық мысал ретінде Neurospora crassa — сақырауқұлағындағы триптофансинтетаза ферментінің түзілуін келтіруге болады. Бұл саңырауқұлақтың кәдімгі штаммы жасанды ортада жасанды өсіргенде олардың ішінде кейбір споралардың тек триптофанды сол ортаға қосқанда ғана өсетіндігі байқалған. Бұл жағдай спораның бұл штамында, триптофан синтездейдін ферменттің жоқ болуы мүмкін екенін білдіреді. Ал генетикалық анализ нәтижесі, Мендельдің заңдарына сәйкес, триптофан қажеттілігі тұқым қуалаушылық жолдары бойынша керектігін көрсетеді. Осылай болғанмен де пайда болu