Билет 32. Процессы на границе металл раствор. Электродный потенциал.
Растворимость одного вещества в другом – свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда осуществляется переход веществ через поверхность их контакта.
Любой металл растворяется в воде, однако растворимость металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и образуется раствор гидроксида.
Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается лечебная «серебряная вода». Таким образом, одни металлы хорошо растворяются в воде, другие – крайне плохо. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает область химической науки – электрохимия.
Ниже мы поговорим об особой группе электрохимических реакций, протекающих на границе раздела фаз, в частности металл–вода (или раствор соли металла). Эти реакции характеризуются переносом заряда (электронов) и вещества через границу раздела фаз твердое вещество–жидкость.
Вы знаете, что металл проводит ток благодаря тому, что в его кристаллической решетке есть свободные (точнее, слабо связанные с атомами) электроны. А это означает, что в кристаллической решетке имеется некоторое количество положительно заряженных ионов металла.
Если металлическую пластинку, например медную, погрузить в воду или раствор соли меди, то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Cu2+ начнут переходить в воду. Из-за этого пластинка приобретает отрицательный заряд. Между отрицательно заряженной пластинкой и перешедшими в раствор положительно заряженными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов в раствор, т.е. процесс растворения металла прекращается. Подойдя к поверхности пластинки, принимают от нее электроны и, переходя в нейтральное состояние, осаждаются. Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости их осаждения на металле. На рис. 8.5 ион металла для простоты изображен негидратированным.
При контакте металла с водой или раствором соли металла жидкая и кристаллическая фазы приобретают на границе раздела противоположные заряды, в результате чего на межфазной границе образуется двойной электрический слой и возникает разность электрических потенциалов. Равновесие между металлом, жидкой фазой и двойным электрическим слоем полностью подчиняется всем положениям смещения химического равновесия. На рис. 8.5 двойной электрический слой изображен в виде двух плотных слоев электронов и катионов. В действительности каждый слой распространяется по обе стороны от места контакта металла с водой, и постепенно количество электронов и катионов в слоях понижается.
Равновесие между ионами раствора и металлом выражается уравнением
Cu2+ (р-р) + 2е = Сu (кр.).
В уравнении равновесия электрохимической реакции, принимаемые электроны обычно записывают в левой части уравнения, перед знаком равенства. Соблюдение этого правила крайне важно, т.к. по таким уравнениям можно предсказывать направление электродных процессов.
Посмотрите на написанное уравнение – это уравнение окислительно-востановительной реакции! Поэтому все, что вы знаете об окислительно-восстановительных реакциях, следует использовать и для этих реакций.
Система, состоящая из проводника электрического тока и раствора (или расплава) электролита, в который погружен проводник, называется электродом. Так, медная пластинка, погруженная в водный раствор сульфата меди CuSО4, – типичный электрод.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов двух фаз на границе металл–электролит. Непосредственно измерить абсолютное значение электродного потенциала нельзя, но его можно сравнить с потенциалами других электродов (при стандартных условиях).
На медном электроде (медь–раствор с концентрацией ионов Cu2+, равной 1 моль/л) при разомкнутой гальванической цепи устанавливается равновесие, характеризующееся стандартным электродным потенциалом, равным 0,34. В:
Cu2+ + 2e = Cu , E = 0,34 В.
Положительное значение потенциала этой электродной реакции означает, что реакция может проходить самопроизвольно (при наличии второго электрода, поставляющего электроны), т.е. ионы меди могут переходить в металлическую медь (медь будет осаждаться на электроде).
Хотя, разумеется, знак заряда электрода не зависит от способа написания уравнения электродного процесса, при его записи в противоположном направлении знак потенциала необходимо изменить на противоположный.
Стандартный потенциал цинкового электрода равен –0,76 В:
Zn2+ + 2e = Zn, E = –0,76 B.
Отрицательное значение электродного потенциала цинка свидетельствует о невозможности прохождения реакции по этому уравнению. Самопроизвольно проходит процесс в противоположном направлении:
Zn – 2e = Zn2+, E = 0,76 B.
Уравнение этой реакции показывает, что цинк может «растворяться» в кислотах, или, более правильно, цинк реагирует с ионами водорода и образуются ионы цинка и газообразный водород.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т.е. в порядке возрастания их электродных потенциалов, то получится ряд стандартных электродных потенциалов.
Чем более отрицателен (менее положителен) электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель. Металлический литий – самый сильный восстановитель среди металлов, а металлическое золото в данном перечне уравнений реакций – самый слабый восстановитель.
Все металлы, расположенные в этом списке выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в растворах кислот с концентрацией ионов водорода
1 моль/л. Если электродный потенциал металла имеет положительный знак, то металл не растворяется в растворах кислот с 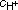 = 1 моль/л.
= 1 моль/л.
Эти правила можно не запоминать, лучше запомнить общий подход (уже вам известный) к определению направления окислительно-восстановительной реакции в гальваническом элементе.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное мерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.