Волновые свойства частиц
Свет обладает как волновыми, так и корпускулярными свойствами. Волновые свойства проявляются при распространении света (интерференция, дифракция). Корпускулярные свойства проявляются при взаимодействии света с веществом (фотоэффект, излучение и поглощение света атомами).
Свойства фотона как частицы (энергия Е и импульс p) связаны с его волновыми свойствами (частотой ν и длиной волны λ) соотношениями
 ;
;  , (19)
, (19)
где h=6,63×10-34 Дж - постоянная Планка.
Пытаясь преодолеть трудности боровской модели атома, французский физик Луи де Бройль в 1924 г. выдвинул гипотезу, что сочетание волновых и корпускулярных свойств присуще не только свету, но и любому материальному телу. То есть частицы вещества (например, электроны) обладают волновыми свойствами. высказал предположение, Согласно де Бройлю каждому телу массой m, движущемуся со скоростью υ, соответствует волновой процесс с длиной волны
 (20)
(20)
. Наиболее ярко волновые свойства проявляются у микрообъектов (элементарных частиц). Вследствие малой массы длина волны де Бройля оказывается сравнимой с межатомным расстоянием в кристаллах. В этих условиях при взаимодействии пучка частиц с кристаллической решеткой возникают дифракционные явления. Электронам с энергией 150 эВ соответствует длина волны λ»10-10 м. Такого же порядка межатомные расстояния в кристаллах. Если пучок таких электронов направить на кристалл, то они будут рассеиваться по законам дифракции. Зафиксированная на фотопленке дифракционная картина (электронограмма) содержит информацию о строении трехмерной кристаллической решетки.
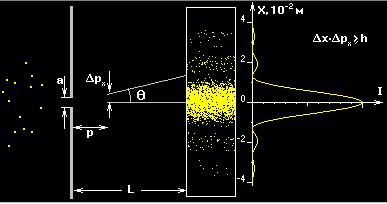
Рисунок 6 Иллюстрация волновых свойств вещества
Для иллюстрации волновых свойств частиц часто используют мысленный эксперимент - прохождение пучка электронов (или других частиц) через щель шириной Δх. С точки зрения волновой теории после дифракции на щели пучок будет уширяться с угловой расходимостью θ»λ/Δх. С корпускулярной точки зрения уширение пучка после прохождения щели объясняется появлением у частиц некоторого поперечного импульса. Разброс значений этого поперечного импульса ("неопределенность") есть
 (21)
(21)
Соотношение  (22)
(22)
носит название соотношения неопределенностей. Это соотношение на корпускулярном языке отражает наличие волновых свойств у частиц.
Эксперимент по прохождению пучка электронов через две близко расположенные щели может служить еще более яркой иллюстрацией волновых свойств частиц. Этот эксперимент является аналогом оптического интерференционного опыта Юнга.
4. 10 Квантовая модель атомаЭкспериментальные факты (дифракция электронов, эффект Комптона, фотоэффект и многие другие) и теоретические модели, вроде боровской модели атома, с определенностью свидетельствуют, что законы классической физики становятся неприменимыми для описания поведения атомов и молекул и их взаимодействия со светом. В течение десятилетия между 1920-м и 1930-м гг. ряд выдающихся физиков ХХ в. (де Бройль, Гейзенберг, Борн, Шредингер, Бор, Паули и др.) занимался построением теории, которая могла бы адекватно описать явления микромира. В результате родилась квантовая механика, ставшая основой всех современных теорий строения вещества, можно сказать, основой (вместе с теорией относительности) физики ХХ в.
Законы квантовой механики применимы в микромире, в то же время мы с вами являемся макроскопическими объектами и живем в макромире, управляющимся совершенно иными, классическими законами. Поэтому неудивительно, что многие положения квантовой механики не могут быть проверены нами непосредственно и воспринимаются как странные, невозможные, непривычные. Тем не менее, квантовая механика является, наверное, самой подтвержденной на опыте теорией, так как следствия расчетов, выполненных по законам этой теории, используются практически во всем, что нас окружает, и стали частью человеческой цивилизации (достаточно упомянуть о тех полупроводниковых элементах, работа которых в данный момент позволяют читателю видеть текст на экране монитора, покрытие которого, кстати, также рассчитано с помощью квантовой механики).
К сожалению, используемый квантовой механикой математический аппарат довольно сложен и идеи квантовой механики могут быть изложены лишь словесно и поэтому недостаточно убедительно. С учетом этого замечания попытаемся дать хоть какое-то представление об этих идеях.
Основным понятием квантовой механики является понятие квантового состояния какого-то микрообъекта, или микросистемы (это может быть отдельная частица, атом, молекула, совокупность атомов и т.п.).
Квантовая модель атома отличается от планетарной в первую очередь тем, что в ней электрон не имеет точно определенной координаты и скорости, поэтому бессмысленно говорить о траектории его движения. Можно определить (и нарисовать) только границы области его преимущественного движения (орбитали).
Состояние какого-то микрообъекта, или микросистемы (это может быть отдельная частица, атом, молекула, совокупность атомов и т.п.) может быть охарактеризовано заданием квантовых чисел: значений энергии, импульса, момента импульса, проекции этого момента импульса на какую-то ось, заряда и т.п.
УРАВНЕНИЕ ШРЕДИНГЕРА для движения электрона в кулоновском поле ядра атома водорода используется для анализа квантовой модели атома. В результате решения этого уравнения получается волновая функция, которая зависит не только от координаты  и времени t, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.
и времени t, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.
Главное квантовое число n может принимать целочисленные значения 1, 2, ... . Оно определяет величину энергии электрона в атоме
 (23)
(23)
, где Еi - энергия ионизации атома водорода (13,6 эВ).
АЗИМУТАЛЬНОЕ (ОРБИТАЛЬНОЕ) квантовое число l определяет модуль момента импульса электрона при его орбитальном движении  (24)
(24)
. Оно принимает целочисленные значения l = 0, 1, 2, ... n-1 .
МАГНИТНОЕ квантовое число ml определяет проекцию вектора момента импульса орбитального движения электрона LZ на направление внешнего магнитного поля  . Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равные l .
. Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равные l .  , (25)
, (25)
где ml = 0, ±1, ±2, ... , ±l .
МАГНИТНОЕ спиновое квантовое число mS определяет проекцию вектора собственного момента импульса электрона (СПИНА  ) на направление внешнего магнитного поля
) на направление внешнего магнитного поля  :
:
SZ =  mS и принимает только 2 значения: mS = +1/2, -1/2. Для модуля спина
mS и принимает только 2 значения: mS = +1/2, -1/2. Для модуля спина  , (26)
, (26)
где s – спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электрона s =  (аналогично, для протона и нейтрона). Для фотона s = 1.
(аналогично, для протона и нейтрона). Для фотона s = 1.
Вырожденными называются состояния электрона с одинаковой энергией.
КРАТНОСТЬ ВЫРОЖДЕНИЯравна количеству состояний с одной и той же энергией.
КРАТКАЯ запись состояния электрона в атоме: ЦИФРА, равная главному квантовому числу, и буква, определяющая азимутальное квантовое число:
Таблица 1 Краткая запись состояния электрона в атоме
| Буква | s | p | d | e | f |
| Значение l |
Таблица 2 Краткая запись состояния электрона в атоме
| Серия | Лаймана | Бальмера | Пашена | Брэкета |
| Переходы | np®1s | ns®2p, nd®2p | nf®3d, np®3d | ng®4f, nd®4f |
ПРАВИЛО ОТБОРА азимутального квантового числа Dl = ±1. Электрон в атоме может переходить только между состояниями, удовлетворяющему указанному правилу.
5 Порядок выполнения работы