Описание установки и методики измерений
ФИЗИКА АТОМА, ТВЕРДОГО ТЕЛА И АТОМНОГО ЯДРА
 Работа 6.1
Работа 6.1
ИЗУЧЕНИЕ ОПТИЧЕСКИХ СПЕКТРОВ ИСПУСКАНИЯ.
АТОМ ВОДОРОДА
Цель работы: 1) ознакомление с устройством и принципом работы спектроскопа;
2) наблюдение линейчатых спектров испускания и градуировка спектроскопа;
3) анализ спектра излучения атома водорода на основе теории Бора.
 Схема экспериментальной установки
Схема экспериментальной установки
Л – источник света;
К – конденсор;
1- входная щель;
2, 4 – микрометрические винты;
3 – коллиматорный объ- ектив;
5 – призма;
6 – поворотный столик;
7 – отсчетный барабан;
8 – объектив;
9 – окуляр;
10 – указатель
Описание установки и методики измерений
Разложить немонохроматичекий свет на спектр можно либо с помощью дифракционной решетки (см. работу 5.2) либо, используя явление дисперсии, с помощью стеклянной призмы. Получаемые спектры называются соответственно дифракционными и дисперсионными. В данной работе применяется второй способ. Для наблюдения спектров и измерения длин волн спектральных линий (упражнение 1) используется высокоточный оптический прибор – универсальный монохроматор-спектрометр УМ–2, принципиальная схема которого изображена выше.
Расходящийся пучок света от источника (лампы) Л собирается конденсором К и попадает на входную щель 1 монохроматора, ширина которой регулируется микрометрическим винтом 2. Дальнейшая фокусировка пучка осуществляется в объективе 3 с помощью микрометрического винта 4. При прохождении света через сложную стеклянную призму 5 (склеенную из трех треугольных призм) лучи различных длин волн преломляются вследствие дисперсии под разными углами. Поворотный столик 6, на котором закреплена призма, может вращаться при помощи микрометрического винта 7 с отсчетным барабаном. При этом в объектив 8 и окуляр 9, а следовательно, и в поле зрения наблюдателя попадают различные участки спектра. Объектив 8 совмещает в своей фокальной плоскости изображение входной щели и указатель 10. Для того, чтобы снять с барабана отсчет, соответствующий определенной линии спектра, ее необходимо совместить с указателем.
Дисперсионные спектры, в отличие от дифракционных, нелинейны: показания прибора (отсчет по шкале N) не связаны с длиной волны l прямо пропорциональной зависимостью. Поэтому спектроскоп нуждается в предварительной градуировке. Для градуировки используется ртутная лампа (длины волн спектра ртути известны). Наблюдая в спектроскоп спектр ртути, снимают отсчеты, соответствующие отдельным линиям, а затем строят график зависимости отсчета N от длины волны l. Этот градуировочный график позволяет потом определять неизвестные значения длин волн спектра исследуемого вещества по снимаемым показаниям данного прибора (в упражнении 1 исследуемым источником света является неоновая лампа).
Кроме спектроскопов, дающих возможность изучать спектры путем их непосредственного наблюдения, существует еще одна разновидность спектральных приборов – спектрографы, с помощью которых получают фотографии спектров на фоне шкалы прибора. На рис. 43 изображены спектрограммы ртути и водорода. Для ртути даны две фотографии, сделанные с различной выдержкой, чтобы четко определить положение линий различной интенсивности, а также указаны соответствующие значения длин волн (как и в первом упражнении, спектр ртути используется для градуировки шкалы спектрографа). На спектрограмме водорода даны лишь порядковые номера линий. Соответствующие длины волн необходимо определить по градуировочному графику. Так как водород «загрязнен» различными примесями, следует выделить в его спектре линии, принадлежащие чистому водороду. Для этого используется теория: значения этих длин волн должны быть близки к теоретическим, определяемым формулой Бальмера.
Как известно, атомы вещества излучают электромагнитные волны в оптическом диапазоне при переходе электронов внешних оболочек с более высоких энергетических уровней на более низкие. Так как при каждом конкретном переходе энергия атома уменьшается на строго определенную величину DW, длина волны излучаемого при этом фотона также имеет строго определенное значение  (см. формулу (1) на с. 123).
(см. формулу (1) на с. 123).
Поэтому спектр испускания атома имеет линейчатый характер, т.е. представляет собой совокупность отдельных цветных полос (в отличие от сплошного спектра, в котором цвета постепенно переходят один в другой).
Наиболее детально изучен спектр самого простого атома – водорода. Длина волны фотона, излучаемого при переходе электрона с k-го на n-й энергетический уровень, определяется обобщенной формулой Бальмера
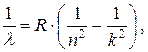 (1)
(1)
где R – постоянная Ридберга. Расчет показывает, что при n = 1 значения длин волн лежат в пределах от 0,091 до 0,122 мкм, т.е. в ультрафиолетовом диапазоне; соответствующие линии спектра образуют невидимую для человеческого глаза серию Лаймана. При n > 2 длины волн испускаемых фотонов соответствуют инфракрасному излучению (l > 0,820 мкм) и образуют серии Пашена (n = 3), Брэкета (n = 4), Пфунда (n = 5) и т.д. Только при переходах электрона на второй энергетический уровень излучаются фотоны видимого света – серия Бальмера. Положив в (1) n = 2, преобразуем формулу Бальмера к виду
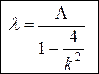 , (2)
, (2)
где
 . (3)
. (3)