Химические свойства
Алюминий
| 
|
|
Химические свойства
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1.
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной пленки можно, добавляя к алюминию такие металлы, как галлий, индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов[11].
Легко реагирует с простыми веществами:
- с кислородом, образуя оксид алюминия:

- с галогенами (кроме фтора)[12], образуя хлорид, бромид или иодид алюминия:

- с другими неметаллами реагирует при нагревании:
· со фтором, образуя фторид алюминия:
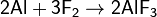
· с серой, образуя сульфид алюминия:
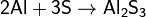
· с азотом, образуя нитрид алюминия:

· с углеродом, образуя карбид алюминия:

Сульфид и карбид алюминия полностью гидролизуются:


Со сложными веществами:
- с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):

- со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
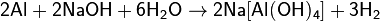

- Легко растворяется в соляной и разбавленной серной кислотах:


- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:


- восстанавливает металлы из их оксидов (алюминотермия):


Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):

СВИНЕЦ
Свинец (Plumbum) Pb — элемент IV группы 6-го периода периодической системы Д. И. Менделеева, п. н. 82, атомная масса 207,19. Самородный Свинец встречается редко, наиболее важный минерал — галенит (свинцовый блеск) PbS. Свинец — мягкий, ковкий и пластичный металл серого цвета. На воздухе быстро покрывается тонким слоем окиси, защищающим его от дальнейшего окисления. В электрохимическом ряду напряжений Свинец стоит непосредственно перед водородом. Разбавленная соляная и серная кислоты почти не действуют на Свинец вследствие малой растворимости PbCl2 и PbSO4. Легко растворяется в азотной кислоте. Свинец, так же как и гидроокись его, растворяется в щелочах, при этом образуются плюмбит-ионы РЬ (ОН)42—. Все растворимые соединения Свинца ядовиты. Свинец получают из сульфидных руд: свинцовый блеск обжигают до окиси свинца, которую восстанавливают углем до металла. Проявляет валентность 2+, а также 4+. Соединения четырехвалентного Свинца значительно менее стойки. Свинец широко используется для производства кабелей и аккумуляторов. Он входит в состав многих сплавов: для подшипников (баббиты), типографского сплава и др. Свинец хорошо поглощает γ-лучи и используется для защиты от γ-излучения при работе с радиоактивными веществами.
ХИМИЧЕСКИЕ СВОЙСТВА
Электронная формула: 5s25p65d106s26p2, энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ. На внешней электронной оболочке находятся 4 неспаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
- Соли двухвалентного свинца реагируют с щелочами, образуя почти нерастворимый гидроксид свинца:

- При избытке щелочи гидроксид растворяется:

- Реагирует со щелочами и кислотами:


Основные соединения свинца
Свинец в соединениях может находиться в степенях окисления +2 и +4, образуя соединения Pb(II) и Pb(IV), соответственно. В обеих степенях окисления свинец является амфотерным и может как выступать в роли катионов Pb2+ и Pb4+, так и входить в состав анионов (плюмбита PbO2-2 с Pb(II) и плюмбатов с Pb(IV): метаплюмбата PbO2-3 и ортоплюмбата PbO2-4), в связи с этим может образовывать четыре типа солей.
Медь
Медь (Cuprum, от лат. названия острова Кипра) Cu — элемент I группы 4-го периода периодической системы Д. И. Менделеева, п. н. 29, атомная масса 63,546. Известна с древнейших времен. В природе встречается как в самородном состоянии, так и в виде различных минералов — халькопирит (медный колчедан) CuFeS2, халькозин (медный блеск) Cu2S, малахит CuCO3·Cu(OH)2 и др., содержится в живых организмах. Медь — металл красного, в изломе розового цвета, ковкий, тягучий. Отличительными свойствами Меди являются высокая электро- и теплопроводность (как проводник тока занимает среди металлов 2-е место после серебра). Химически Медь малоактивна, во влажном воздухе на ее поверхности образуется зеленая пленка основного карбоната меди. В соединениях проявляет валентность 1+, 2+. Легко соединяется с галогенами, серой, селеном; растворяется в HNO3. Медь образует комплексные соединения с аммиаком, цианидами и др. Соли Меди ядовиты. Более 50% добываемой Меди применяется в электротехнической промышленности (чистая медь); большое значение имеют сплавы (латуни, бронзы, мельхиоры и др.). Соли Меди применяют для борьбы с вредителями в сельском хозяйстве, как микроудобрения, катализаторы и др.