Коллигативные свойства растворов.
Растворы.
1.Только сильные электролиты перечислены в ряду:
1) H2S, HCl, H2SO4
2) HClO4,KCl, HNO3
3) HCN, CH3COOH, NH4OH,
4) NaOH, H2Se, HI
2.Электрический ток не проводят водные растворы:
1) ацетата Na
2) хлорид метиламмония
3) муравьиной кислоты
4) глицерина
3.Диссоциацию глюкозы описывает уравнение:
1) С6Н12О6 → 6С4++12Н+ + 6О2-
2) глюкоза не диссоциирует
3) С6Н12О6 → 12Н+ + 6СО-
4) С6Н12О6 → 6С4+ + 6Н2О
4.Степень диссоциации слабого электролита увеличивается при:
1) добавлении одноименного иона
2) увеличении концентрации раствора
3) разведении раствора
4) охлаждении раствора
5.Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
6.Коэффициент активности иона тем больше, чем:
1) больше концентрация электролита
2) меньше концентрация электролита
3) меньше растворимость электролита
4) не зависит от концентрации электролита
7.Ионная сила раствора – это:
1) произведение концентрации иона на квадрат его заряда
2) произведение концентрации иона на его заряд
3) сумма произведения концентрации ионов на квадрат их зарядов
4) полусумма произведения концентрации ионов на квадрат их зарядов
8.Коэффициент активности ионов (fi) в очень разбавленных растворах равен:
1) 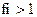
2) 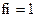
3) 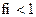
4) 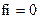
9.Ионная сила плазмы крови человека равна 0,15 м, заменителем плазмы крови является:
1) 0,7 м раствор глюкозы
2) 0,15 м раствор карбоната натрия
3) 0,9% раствор хлорида натрия
4) 1,9% раствор хлорида натрия
10.Смешали 200г 20%-ного и 300г 10%-ного растворов глюкозы. Массовая доля вещества в полученном растворе равна в %:
1)15
2)16
3)18
4)14
11.Раствор, содержащий 20 г вещества в 400 г воды кипит при температуре 100,22 °С (К H2O = 0,52 град.·кг/ моль). Молярная масса растворенного вещества равна:
1) 115 г/моль
2) 110 г/моль
3) 125 г/моль
4) 118 г/моль
12.Молярная масса вещества 40 г/моль. Ккр=1.86. Температура замерзания раствора, состоящего из 300 г воды и 20 г растворенного вещества, составляет:
1) -2.7 0С
2) -1.7 0С
3) -3.1 0С
4) -0.93 0С
13.При введении больному 20%-ного раствора глюкозы наблюдается:
1) осмотический шок
2) осмотический конфликт
3) изменения осмотического давления не происходит
4) повышение рН крови
14.Осмотическое давление крови составляет при 37°С:
1) 500-600 кПа
2) 750-800 кПа
3) 360-400 кПа
4) 200-300 кПа
15.Температура замерзания сантимоляльного раствора NaCI по сравнению с сантимоляльным раствором глюкозы:
1) выше
2) ниже
3) их температуры замерзания одинаковы
4) зависит от давления
16.Будут ли изотоническими 10%-ные растворы глюкозы и фруктозы?
1) да
2) нет
3) будут осмолярными
4) будут осмоляльными
17.В 5%-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
18.Осмотическое давление пропорционально:
1) молярной концентрации
2) молярной концентрации эквивалента
3) моляльной концентрации
4) мольной доле вещества
19.Температурой кипения жидкости является температура, при которой давление ее паров становится…
1) равным внешнему давлению
2) меньше внешнего давления
3) больше внешнего давления
4) зависит от формы сосуда
20.Криоскопические и эбуллиоскопические постоянные зависят от:
1) природы растворителя
2) температуры
3) природы растворенного вещества
4) числа частиц растворенного вещества
21.В 200 г. физиологического раствора ( 0,9% NaCl) содержится NaCl :
1) 18 г.
2) 1.8 г.
3) 0.18 г.
4. 0.018 г.
22.Гемоглобин 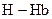 (
( 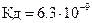 ) и оксигемоглобин
) и оксигемоглобин 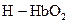 (
( 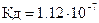 ) являются слабыми кислотами. Какой из анионов:
) являются слабыми кислотами. Какой из анионов: 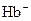 или
или 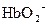 прочнее связывает протоны
прочнее связывает протоны 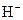 ?
?
1) 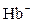
2) 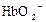
3)не связывают
4) 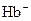 и
и 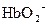
23.Для приготовления физиологического раствора необходимо добавить к 100 мл воды:
1) 9 г глюкозы
2) 9 г хлорида калия 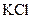 ;
;
3) 0.09 г хлорида кальция 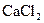 .
.
4) 0.9 г хлорида натрия 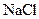 ;
;
24.В 1000 г воды находится 1.5 моль вещества. Это:
1) процентная концентрация
2) молярная концентрация (молярность)
3) моляльная концентрация (моляльность)
4) эквивалентная концентрация (нормальность)
25.Титр показывает сколько:
1) граммов вещества содержится в 1 мл раствора;
2) граммов вещества содержится в 1 л раствора;
3) граммов вещества содержится в 1 кг растворителя;
4) моль вещества содержится в 1 л раствора.
26.Запись: «0,89%-ный раствор NaCl» означает, что:
1) в 100 г раствора содержится 0,89 г NaCl;
2) в 100 мл раствора содержится 0,89 г NaCJ;
3) в 1 л раствора содержится 0,89 г NaCJ;
4) в 1 кг раствора содержится 0,89 NaCl.
27.С разбавлением раствора слабого электролита
1) уменьшается константа диссоциации 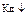 ;
;
2) увеличивается степень диссоциации 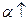 ;
;
3) увеличивается ионное произведение воды 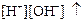 .
.
4) уменьшается объем раствора
28.В 100 мл водного раствора содержится 36,5 г HCl. Молярная концентрация раствора равна:
1) 10 М
2) 0,1 М
3) 2 М
4) 0,01 М
29.Пациенту ввели внутримышечно 1 мл 2% раствора лекарственного препарата. Сколько мг препарата введено пациенту:
1)20 мг
2)200 мг
3)0,2 мг.
4)2 мг
30.Хлороводород массой 20г растворили в 180 г воды. Массовая доля вещества в полученном растворе равна:
1) 15%
2) 20%
3) 10%
4) 18%
31.В 40 г. CaCO3 (М=100г/моль)содержится вещества карбоната кальция следующее количество:
1) 0.4 моль
2) 0.2 моль
3) 0.1 моль
4) 0.6 моль
32.Запись: «3М раствор глюкозы» означает, что:
1) в 1 л раствора содержится 3 моль глюкозы;
2) в 100 мл раствора содержится 0.3 моль глюкозы;
3) в 1 кг раствора содержится 3 моль глюкозы;
4) в 100 мл раствора содержится 3 моль глюкозы.
33.К 75 г воды добавили 25 г серной кислоты. Массовая доля вещества в полученном растворе составляет:
1.) 40%
2)20%
3) 25%
4) 50%
34.Активная кислотность – это:
1) общая концентрация ионов 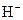 ;
;
2) связанная в молекулы концентрация 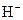 ;
;
3) свободная концентрация ионов 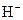 в растворе.
в растворе.
4) содержание Н+ ионов в слабых кислотах
35.Коллигативные свойства раствора зависит от:
1) природы растворителя и растворенного вещества
2) температуры
3) числа частиц растворенного вещества
4) зависят от формы сосуда
36.У морских животных по сравнению с пресноводными животными осмотическое давление крови:
1) выше
2) ниже
3) одинаково
4) зависит от животного
37.Физиологическим раствором является:
1) 2% раствор глюкозы;
2) 0.9% раствор хлорида натрия 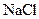 ;
;
3) 1.2% раствор сульфата магния 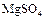 .
.
4) 5% раствор молочной кислоты;
38.Температура замерзания децимоляльного раствора NaCI по сравнению с децимоляльным раствором АICl3
1) ниже
2) выше
3) одинаковы
4) зависит от объема
39.Раствор, содержащий 20 г вещества в 400 г воды кипит при температуре 100,11 °С (К H2O = 0,52 град.·кг/моль). Молярная масса растворенного вещества равна:
1)115 г/ моль
2) 110 г/ моль
3) 125 г/моль
4) 236 г/моль
40.Молярная масса вещества 40 г/моль. Ккр=1.86. Температура замерзания раствора, состоящего из 300 г воды и 20 г растворенного вещества, составляет:
1) -2.7 0С
2) -1.7 0С
3) -3.1 0С
4) -0.93 0С
41.При введении больному 20%-ного раствора глюкозы наблюдается:
1) осмотический шок
2) осмотический конфликт
3) изменения осмотического давления не происходит
4) повышение рН крови
42.Осмотическое давление крови составляет при 37°С:
1) 500-600 кПа
2) 750-800 кПа
3) 360-400 кПа
4) 200-300 кПа
43.Будут ли изотоническими 10%-ные растворы глюкозы и фруктозы?
1) да
2) нет
3) будут осмолярными
4) будут осмоляльными
44.В 5%-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
45.Степень диссоциации слабого электролита, уменьшается при:
1) добавлении одноименного иона
2) увеличением температуры
3) разбавлении
4) увеличении давления
46.Уравнение 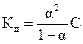 называется законом:
называется законом:
1) выпаривания Оствальда
2) отведения Оствальда
3) разведения Оствальда
4) смешивания Оствальда
47.Коэффициент активности иона не зависит от:
1) концентрации иона
2) температуры
3) концентрации других ионов
4) давления
48.Математическое выражение коэффициента активности 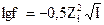 - это уравнение:
- это уравнение:
1) Галлера
2) Смолуховского
3) Дебая-Хюккеля
4) Генри
49.Физиологический раствор – это:
1) 1% раствор карбоната натрия
2) 1% раствор хлорида натрия
3) 0,9% раствор карбоната натрия
4) 0,9% раствор хлорида натрия
50.Смешали 300г 15% и 200г 25% растворов глюкозы. Массовая доля вещества в полученном растворе равна:
1) 15 %
2) 18 %
3) 20 %
4) 19 %
51.К 100 г 5% NaCl добавили 150 г воды. Массовая доля вещества в растворе составляет:
1)3 %
2) 2 %
3) 4 %
4) 8 %
52.Морской водой нельзя утолить жажду, так как по отношению к биологическим жидкостям она:
1) изотонична
2) гипотонична
3) гипертонична
4) токсична
53.Опишите поведение эритроцитов в 0,5%-ном растворе NaCl. Каким будет этот раствор по отношению к плазме крови?
1) гемолиз, гипотоническим
2) плазмолиз, гипотоническим
3) гемолиз, гипертоническим
4) плазмолиз, гипертоническим
54.Рабочие «горячих» цехов должны пить подсоленную воду, так как в результате повышенного потовыделения осмотическое давление у них:
1) понижается
2) повышается
3) не изменяется
4) сначала понижается, затем повышается
55.При введении гипотонических растворов наблюдается:
1) осмотический шок
2) осмотический конфликт
3) ацидоз
4) алкалоз
56.В 20%-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
57.5%-ный раствор NaCl является по отношению к плазме крови:
1) гипотоническим
2) гипертоническим
3) изотоническим
4) осмоляльным
58.Физиологический раствор по отношению к сыворотке крови является:
1) изотоническим
2) гипотоническим
3) гипертоническим
4) антагонистом
59.Зимой посыпают солью дороги для того, чтобы:
1) повысить температуру таяния льда
2) понизить температуру таяние льда
3) температура таяния льда не меняется
4) сначала повысить, затем уменьшить
60.Относительное понижение давления пара над раствором пропорционально:
1) молярной доле растворенного вещества
2) молярной концентрации растворенного вещества
3) моляльной концентрации растворенного вещества
4) молярной доле растворителя
61.Повышение температуры кипения и понижение температуры замерзания пропорционально:
1) молярной концентрации
2) моляльной концентрации
3) молярной концентрации эквивалента
4) молярной доле растворенного вещества
62.Только слабые электролиты перечислены в ряду:
1) NH4OH, H2S, H2SO3
2) H2CO3, NaCl, CH3COOH
3) HClO, KOH, MgSO4
4) CaCl2, H2Te, HI
63.Электролитом не является:
1) расплав КОН
2) азотная кислота
3) раствор NaOH
4) этиловый спирт
64.Степень диссоциации в растворах слабых электролитов – это отношение:
1) количества молекул продиссоциированных к общему количеству молекул вещества
2) общего количества молекул вещества к количеству, продиссоциированных молекул
3) активной концентрации вещества к общей концентрации вещества в растворе
4) общей концентрации вещества в растворе к активной концентрации вещества
65.При увеличении концентрации электролита, степень диссоциации:
1) увеличивается
2) уменьшается
3) не зависит от концентрации
4) сначала увеличивается, затем уменьшается
66.Константа диссоциации слабого электролита зависит от:
1) концентрации
2) разбавления
3) природы вещества и растворителя
4) давления
67.Концентрация иона SO42- в 0,01 м растворе соли Al2(SO4)3:
1) 0,01 м
2) 0,02 м
3) 0,03 м
4) 0,05 м
68.С увеличением ионной силы раствора коэффициент активности иона в уравнении 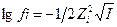 :
:
1) уменьшается
2) увеличивается
3) не изменяется
4) вначале увеличивается, затем остается постоянным
69.Ионная сила плазмы крови человека равна:
1) 0,25 м
2) 0,15 м
3) 0,9 м
4) 0,3 м
70.При некоторых заболеваниях в кровь вводят 0,89% NaCl. Определите массу соли, введенную в организм при вливании 400 мл этого раствора (плотность раствора 1г/ мл) .
1) 35,6
2) 0,356
3) 3,56
4) 3,6
71.Для приготовления 100 г изотонического раствора необходимо взять:
1) 0,89 г NaCl и 99,11 г воды;
2) 0,89 г NaCl и 98,11 г воды;
3) 8,9 г NaCl и 91,1 г воды;
4) 0,089 г NaCl и 99,911 г воды.
72.Рабочие «горячих» цехов должны пить подсоленную воды, так как в результате повышенного потоотделения осмотическое давление у них:
1) понижается
2) повышается
3) не меняется
4) сначала понижается, затем повышается
73.Опишите поведение эритроцитов в 5%-ном растворе NaCl. Каким будет
этот раствор по отношению к плазме крови?
1) гемолиз, гипотоническим
2) плазмолиз, гипотоническим
3) гемолиз, гипертоническим
4) плазмолиз, гипертоническим
74.Изотонический раствор - это:
1) 0,89%-ный раствор NaCl;
2) 8,9%-ный раствор NaCl;
3) 0,089%-ный раствор NaCl;
4) 1 ,00 %-ный раствор NaCl.
75.Чем объясняется слабительный эффект сульфата магния;
1)осмосом воды в просвет кишечника;
2)диффузией соли в полости кишечника;
3)осмосом соли и воды из полости кишечника?
4)образованием осадков
76.Солевые слабительные средства (сульфаты натрия, магния, карловарская соль) в кишечнике осмотическое давление:
1) уменьшают
2) увеличивают
3) не изменяется
4) сначала уменьшают, затем увеличивают
77.При введении гипертонических растворов наблюдается:
1) осмотический шок
2) осмотический конфликт
3) флуороз
4) ацидоз
78.Температура кипения децимоляльного раствора KCL по сравнению с децимоляльным раствором сахарозы:
1) выше
2) ниже
3) их температуры одинаковы
4) зависит от давления
79.В 2%-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
80.Осмос – это направленный самопроизвольный переход молекул растворителя через мембрану из:
1) раствора с меньшей концентрацией в раствор с большой концентрацией
2) раствора с большей концентрацией в раствор с меньшей концентрацией
3) зависит от температуры
4) зависит от объема