Энергетические уровни атома
Энергия электрона, находящегося на стационарной орбите, называется уровнем энергии атома (энергетическим уровнем). С увеличением квантового числа энергия атома возрастает и при n®¥ , E®0.
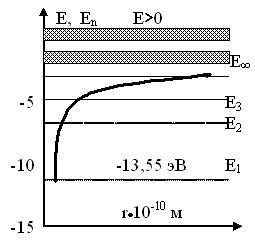
Уровни значений полной энергии атома водорода представлены на рис.77.
С возрастанием квантового числа увеличивается расстояние (радиус орбиты, по которой движется электрон), а полная и потенциальная энергия стремится к нулю. Кинетическая энергия также стремится к нулю и область E>0 соответствует состоянию свободного электрона.
Кроме главного квантового числа n= 1,2,3… состояние атома характеризуется орбитальным ℓ=0,1,2,… n-1, определяющим форму орбиты, магнитным m1 = -1,…,-1,0,+1,…,+1 (ориентация орбиты в пространстве), магнитным спиновым ms= -1/2; +1/2 (собственное вращение электрона в атоме). То есть для одинакового главного квантового числа существует множество состояний электрона (энергетических состояний), распределение, которых удовлетворяет двум принципам:
Рис.77
1. В атоме состояние всех электронов различны, то есть не может быть электронов, имеющих одинаковую комбинацию квантовых чисел (принцип исключения) - установлен в 1925 году швейцарским физиком В.Паули].
2. Распределение электронов в атоме должно соответствовать минимуму энергии атома (принцип минимума энергии).
Общее число электронов в атоме определяется зарядом его ядра, выраженным через элементарный заряд. У атома с минимальной энергией (невозбужденного) электроны заполняют ближайшие к ядру слои, имеющим n оболочек (от 0 до n-1) с определенным количеством электронов в каждой из них.
Построение этой теории стало возможным благодаря тщательным исследованиям спектров излучения различных газов (спектров излучения атомов), в результате которых были обнаружены спектральные линии, расположенные по определенной закономерности. В атоме водорода, например, эта закономерность определена формулой Бальмера-Ридберга
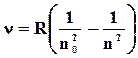 , (170)
, (170)
где 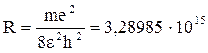
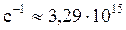 с-1 – постоянная Ридберга, n и n0 – квантовые числа, соответствующие начальному (до излучения) и конечному (после излучения) энергетическим состояниям атома.
с-1 – постоянная Ридберга, n и n0 – квантовые числа, соответствующие начальному (до излучения) и конечному (после излучения) энергетическим состояниям атома.
При переходе электрона с одной стационарной орбиты на другую (ближнюю к ядру) атом излучает квант энергии, равный разности энергий атома до и после излучения 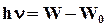 .
.
В спектре можно выделить группы линий, которые получили название спектральных серий. Каждая серия соответствует переходам возбужденного атома на один и тот же энергетический уровень (рис.78)
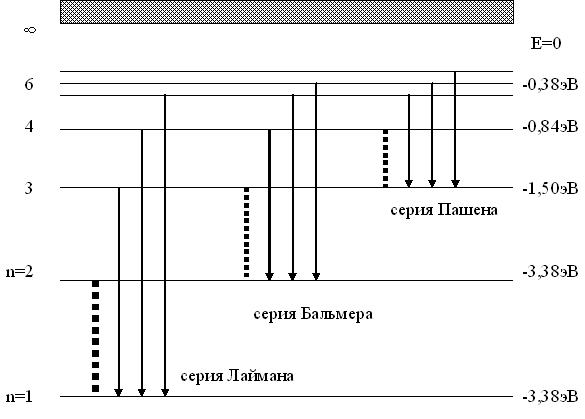
Рис.78
Серия Лаймана расположена в ультрафиолетовой части спектра. Она образуется в результате перехода электронов с верхних энергетических уровней на основной (n=1). Из формулы (45) следует
 , n= 2,3,4……(171)
, n= 2,3,4……(171)
Интенсивность возрастает с уменьшением длины волны.
Серия Бальмера находится в видимой и близкой к ультрафиолетовой областях спектра. Она обнаружена в 1885 году швейцарским физиком Бальмером и является, по сути, началом построения квантовой теории атома. Из (22) для этой серии следует
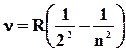 , n= 3,4,5…..(172)
, n= 3,4,5…..(172)
Серия Пашена находится в инфракрасной области спектра. Она возникает при переходе электронов на третий энергетический уровень. Из (22) следует
 , n= 4,5,6…..(173)
, n= 4,5,6…..(173)
Существуют и другие серии, однако спектр ограничен, так как энергетические уровни атома по мере увеличения главного квантового числа сближаются и вероятность перехода между ними мала, поэтому они практически не наблюдаются.
Основные параметры спектральных линий представлены в таблице 2.
Таблица 2 - Основные параметры спектральных линий
| Параметры | Серия Лаймана | Серия Бальмера | Серия Пашена |
| n | 2 3 4 5 | 3 4 5 6 | 4 5 6 |
| Е (эВ) | 10,2 12,1 12,7 13,0 | 1,88 2,54 2,84 3,00 | 0,66 0,96 1,12 |
| ν ∙1015 Гц | 2,45 1,03 0,98 0,96 | 0,45 0,61 0,69 0,72 | 0,16 0,23 0,27 |
| λ (мкм) | 0,122 0,29 0,30 0,31 | 0,66 0,49 0,44 0,42 | 1,89 1,30 1,11 |
В спектральном анализе используются как спектры излучения (эмиссионные) – спектральный анализ, так и спектры поглощения – абсорбционный анализ. Внешний вид спектров разнообразен и определяется источником излучения. Различают три основных типов спектров – сполошные, линейчатые и полосатые (см. глава 1 часть III).
В сплошном спектре имеются все длины волн (цвета) непрерывно изменяющиеся от длинноволновой части спектра к коротковолновой. Они образуются в результате совокупности многих взаимодействий между собой молекул и атомов при их хаотическом движении.
Линейчатые спектры состоят из ряда линий, каждой из которых соответствует определенная частота излучения. Они характерны для возбужденных атомов, не взаимодействующих друг с другом.
Полосатые спектры образуются молекулами. Излучение вызвано как электронными переходами в атомах, так и колебательными движениями самих атомов в молекулах. Эти спектры состоят из большого числа линий расположенных отдельными группами. Сложность молекулярных спектров обусловлена более сложным внутримолекулярным движением.
Квантовая теория строения атома достаточно убедительно объясняет такие физические явления как люминесценция, фотоэффект и световое давление, а также все наблюдаемые закономерности теплового излучения.