Процентная концентрация (массовая доля вещества в растворе)
При решении задач только с вычислением процентной концентрации вещества не требует обязательного знания формулы вещества, так как в расчетах не нужна молекулярная или молярная масса вещества.
Массовая доля или процентная концентрация показывает массу растворенного вещества в 100 граммах раствора и вычисляется по формуле:
 6
6
W  · 100% (1)
· 100% (1)
При вычислении любой величины, выраженной в долях, меньшую величину делим на большую, то есть, в числителе дроби записывается значение для величины, составляющей часть всего целого.
Преобразованная формула с учетом того, что масса раствора складывается из массы вещества и массы растворителя:

W  · 100% (2)
· 100% (2)
Вычислим массу вещества из формулы (1):
 |
m (в-ва) =  (3)
(3)
В случае затруднений в расчетах необходимо пользоваться некоторыми приемами. Эти приемы обозначены значком: ■
 ■ При работе с дробями помните простые вычисления, например
■ При работе с дробями помните простые вычисления, например
3 = 
Сравним с формулой (2). Букве W соответствует число 3. Число 6 соответствует m (в-ва), а число 2 соответствует m (р-ра).Для того чтобы получить число 6 необходимо 3·2. Следовательно, для расчетов значений, находящихся в числителе дроби необходимо результат умножить на значение в знаменателе. В нашем случае – это формула (3).
■ Также при вычислениях массовой доли можно исходить из следующих рассуждений:
1. Масса вещества меньше массы всего раствора, но при вычислении ее производится математическое действие по смыслу противоположное – умножение (содержит корень «множ»)
2. Масса раствора больше, чем масса вещества, однако производится действие деления (по смыслу: дробление – уменьшение)
3. Значение «100%» записываем в дроби в противоположной стороне от значения «W»
Задача 1: Вычислить массовую долю соли в растворе. Масса раствора 420 г. Масса соли 60 г.
 Дано: Решение
Дано: Решение
m(соли) = 60 г 2. Находим массовую долю NaOH в этом растворе:
m(р-ра) =420 г W  =
=  ·100% =14,29%
·100% =14,29%
w ,%(соли) -?
Ответ: Массовая доля соли составляет 14,29%
Задача 2: Вычислить массовую долю гидроксида калия в растворе, образованном 475 г воды и 25 г щелочи.
Дано: Решение

m(H2O) =325г 1.Находим общую массу раствора:
m(КOH) = 25 г m(H2O) + m(КOH) = 325 +25 = 3500

w ,%(КOH) -? 2. Находим массовую долю NaOH в этом растворе:
W  =
=  ·100% =7,1%
·100% =7,1%
Ответ: Массовая доля КOH составляет 7,1%
В этих 2-х задачах речь идет об одном растворе.
Задача 3: Вычислить массу вещества хлороводорода, если известно, что масса раствора составляет 540 г, а массовая доля хлороводорода равна 15 %.
Дано: Решение 
m(р-ра) =450г 1. По формуле (3):
w ,%(HCl) =15 % m (в-ва) =  =
=
 =
= 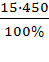 = 7.5 г
= 7.5 г
m (HCl) -? Ответ: масса чистого HCl в растворе -7,5 г
Задача 4: Вычислить массу воды в растворе соли, если известно, что масса раствора составляет 500 г, а массовая доля соли равна 22 %.
При решении данной задачи можно использовать 2 способа.
1 способ:
Дано: Решение 
Начало решения задачи как у предыдущей
m(р-ра) =500 г 1. По формуле (3):
 w ,%(соли) =22% m (в-ва) =
w ,%(соли) =22% m (в-ва) =  = =
= =  = 110 г
= 110 г
m (воды) -? 2. m (воды) = m(р-ра) – m(соли) = 500- 110 =390 г
Ответ: масса воды в растворе - 390 г
2 способ:
 Дано: Решение
Дано: Решение
m(р-ра) =500 г 1.Вычислим массовую долю воды в растворе:
w (воды) = 100 % - 22 % = 78 %
w ,%(соли) =22% 2. Вычислим сразу массу воды в растворе,
 m (воды) -? рассуждая, что вода в растворе такая же часть,
m (воды) -? рассуждая, что вода в растворе такая же часть,
как и вещество. Поэтому воспользуемся формулой (1), но заменим индекс
«в-ва» на - «воды»
W  · 100%
· 100%
m (воды) =  =
=
=  = 390 г
= 390 г
Ответ: масса воды в растворе - 390 г
В том случае, когда требуется в задаче найти и массу вещества. и массу воды, лучше воспользоваться способом 1.
При решении задач по теме «Растворы», как и при решении любых задач, необходимо тщательно познакомиться с условием задачи. Проанализировать его и правильно записать сокращенное условие («дано» и «найти»). Правильное оформление сокращенного условия – это половина решенной задачи!
Если при анализе задачи вы поняли, что речь идет о нескольких растворах, то в условии проставляют индексы: 1,2,3 и т.д.
Задача 5: К раствору массой 250 г с содержанием вещества 12% добавили 300 г воды. Какова массовая доля полученного раствора?
Рассуждения:а) в задаче речь идет о двух растворах;
б) связкой между двумя растворами является масса
чистого вещества, которое в неизменном виде с той же массой остается в новом растворе. Это значит, что масса вещества должна быть вычислена из данных по первому раствору и затем использована для расчетов второго раствора.
Дано: Решение: 
m(р-ра)1 =250г 1. По формуле (3):
w ,%(в-ва)1 =12 % m (в-ва)1 =  =
=
 m (H2O)доб. =300 г =
m (H2O)доб. =300 г = 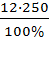 = 30 г
= 30 г
w(в-ва)2 -? 2. m (в-ва)2 =  m (в-ва)1= 30 г
m (в-ва)1= 30 г
m (р-ра)2 = m(р-ра)1+ m (H2O)доб=250+300=550 (г)
3. Воспользуемся формулой (1):
W  =
=  ·100 % = 5,45 %
·100 % = 5,45 %
Ответ: массовая доля вещества в р-ре 2 составляет 5,45 %.
Часто в задачах на тему «Растворы» используют вычисления, связанные не с массой растворов, а с объемами растворов, и при этом не обойтись без применения величины плотности раствора или плотности воды.
Вспомним, что такое плотность. Плотность показывает, какова масса в единице объема либо чистого вещества (например, чистой меди), либо раствора (вместе и вещества и растворителя). Чем больше вещества в растворе, тем плотность выше и, значит, масса единицы объема раствора возрастает. Для воды плотность принята 1 г/см3 или 1 г/мл. Эти размерности в задачах используются чаще всего.
Общая формула для вычисления плотности:


 =
=  (4)
(4)  =
=  (5)
(5)
 |
Для раствора:  (6)
(6)
При вычислении в задачах масс вещества или раствора, а так же массовой доли значения объемов растворов необходимо переводить в массы, используя данные формулы.
Для взаимных переводов величин можно использовать следующий прием: приведем запись в виде треугольника:
 |

Если нужно что-то рассчитать - закрыть эту величину и видно, как проводить расчет.
масса обязательно находится в числителе, плотность и объем – в знаменателе (это необходимо запомнить!); если находим массу раствора , то закрывает знак массы и видим, что следует значение объема умножить на значение плотности; для нахождения объема раствор закрываем знак объема и видим, что необходимо массу разделить на плотность; так же найдем и плотность.
Задача 6: Из раствора массой 350 г с содержанием вещества 20% вещества выпарили 200 мл воды. Какова массовая доля полученного раствора?
Рассуждения, как и в задаче №5
 Дано: Решение: m(р-ра)1 =350г 1. По формуле (3):
Дано: Решение: m(р-ра)1 =350г 1. По формуле (3):
w ,%(в-ва)1 =20 % m (в-ва)1 =  =
=
m (H2O)вып.=200 мл =  = 70 г
= 70 г
 w(в-ва)2 -? 2. m (в-ва)2 =
w(в-ва)2 -? 2. m (в-ва)2 =  m (в-ва)1= 70 г
m (в-ва)1= 70 г
3. m (р-ра)2 = m(р-ра)1- m (H2O)вып .
Не смотря на то, что 𝛒 (воды) =1 все равно производим расчет по формуле: m(воды)= 𝛒·V=
1г/мл ·200 мл = 200 г
m (р-ра)2 = m(р-ра)1- m (H2O)вып.=350-200=150 (г)
4. Воспользуемся формулой (1):
W  =
=  ·100 % = 46,6 %
·100 % = 46,6 %
Ответ: массовая доля вещества в р-ре 2 составляет 46,6 %.
Задача 7: К раствору соли объемом 150 мл с содержанием вещества 5% и плотностью 1,12 г/мл добавили 200 мл воды. Какова массовая доля полученного раствора?
 Дано: Решение:
Дано: Решение:
1. m (р-ра )1= 𝛒·V = 1,12г/мл · 150 мл = 168 г
V(р-ра)1 =150 мл По формуле (3):
w ,%(в-ва)1 =5 % 2. m (в-ва)1 = 
𝛒 (р-ра)1=1,12 г/мл =  = 8,4 г
= 8,4 г
V(H2O)доб.=200 мл
 w(в-ва)2 -? 3. m (в-ва)2 =
w(в-ва)2 -? 3. m (в-ва)2 =  m (в-ва)1= 8,4 г
m (в-ва)1= 8,4 г
4. m(воды)= 𝛒·V=1г/мл ·200 мл = 200 г
5. m (р-ра)2 = m(р-ра)1+ m (H2O)доб=168 г+200 г =
368 г
6. Воспользуемся формулой (1):
W2  =
= 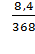 ·100 % = 2,28 %
·100 % = 2,28 %
Ответ: массовая доля вещества в р-ре (2) составляет 2,28 %.
Все рассмотренные выше задачи не требуют расчетов по уравнениям реакций, так как это задачи только на расчет концентраций или масс или объемов растворов. Но существуют задачи, когда нужно провести расчеты по взаимодействию веществ находящихся в растворенном состоянии. Понятно, что в реакцию вступает чистое вещество, исключая растворитель.
Задача 8: Определить массу полученной соли если в реакцию с соляной кислотой вступило 400 мл 20 %-го раствора гидроксида натрия. (р-ра NaOH.)= 1,2 г/мл.
 Дано: Решение:
Дано: Решение:
1. m (р-ра )NaOH= 𝛒·V = 1,2г/мл · 400 мл = 480 г
V(р-ра)NaOH =400 мл 2. По формуле (3):
w ,%(NaOH) =20 % m (NaOH) = 
r(р-ра NaOH.)=1,2 г/мл. =  = 96 г
= 96 г
3.
96 г х г
 m(NaCl) -? NaOH + HCl = NaCl + H2O
m(NaCl) -? NaOH + HCl = NaCl + H2O
1 моль 1 моль
М=40г/моль 58,5г/моль
Найдем кол-во вещества NaOH:
ν =  =
=  = 2,4 моль
= 2,4 моль
4. Найдем кол-во вещества NaCl из пропорции количеств веществ
2,4 моль у моль
NaOH + HCl = NaCl + H2O
1 моль 1 моль
 =
=  à у =
à у =  = 2,4 моль
= 2,4 моль
ν (NaCl) = ν (NaOH) = 2,4 моль
5. m (NaCl) = ν·M = 2,4·58,5=140,4 г
Ответ: масса соли, полученной в реакции нейтрализации равна 140,4
грамма
14 Разберем решение задачи, в которой речь идет о трех растворах. Связкой между этими растворами, как и в задачах, где речь идет о двух растворах, являются массы чистых веществ.
Задача 9:Смешали 100 г раствора с массовой долей вещества 20% и 50 г раствора с массовой долей 32 %. Определить массовую долю вещества (в %) в полученном растворе.
Дано: Решение
 m ( р-ра)1 = 100 г
m ( р-ра)1 = 100 г
w % (р-ра)1 = 20 % 1. Найдем массу веществ в первом растворе
m ( р-ра)2 = 50 г
w% ( р-ра)2 = 32 %
w% ( р-ра)3
w · mр-ра 1 20 % ·100 г

 mв-ва 1= = = 20 г
mв-ва 1= = = 20 г
100 % 100 %
1. Найдем массу вещества во втором растворе:
w· mр-ра2 32 % . 50 г
mв-ва 2 = ------------------ = ----------------= 16 г
100 % 100 %
2. Найдем массу третьего раствора: она складывается из масс 1-го и 2-го
растворов
m (р-ра)1 + m (р-ра)2 = 100 г + 50 г = 150 г
3. Найдем массу вещества в 3-м растворе: m1в + m2в = 20г +16 г =36 г
m в-ва 3 36 г

 w3 = · 100% = · 100 % = 24 %
w3 = · 100% = · 100 % = 24 %
m р-ра 3 150 г
Ответ: массовая доля вещества, в 3-м растворе равна 24 %