Допишите уравнение реакции
Часть I
1. Признаки реакций замещения:
- вступают в реакцию два вещества – простые и сложные;
- образуются в результате реакции также два вещества – новое простое и новое сложное.
2. Два правила ряда активности металлов:
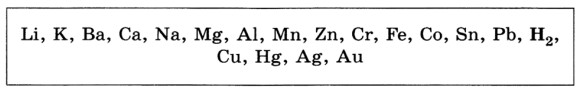
-металлы, стоящие в ряду активности до H2, вытесняют его из растворов кислот;
- металлы, стоящие в ряду активности до металла соли, вытесняют его из растворов солей.
Часть II
1. Запишите уравнения реакций замещения.

Запишите уравнения возможных реакций.

3. Напишите уравнения реакций замещения:

Допишите уравнение реакции

Дайте характеристику записанной реакции по следующим признакам:
1) число и состав исходных веществ и продуктов реакции – замещение;
2) тепловой эффект – экзотермическая;
3) направление протекания – необратимая;
4) участие катализатора – некаталитическая.
5. 39 г технического цинка, содержащего 20% примесей, растворили в избытке соляной кислоты. Найдите объём полученного водорода (н. у.) и количество вещества соли.

Железо массой 1,12 г полностью прореагировало с раствором сульфата меди (II). Найдите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (III) при этом получилось?

Придумайте рисунки «Взаимодействие различных металлов с соляной кислотой» и «Взаимодействие различных кислот с цинком», иллюстрирующие зависимость скорости протекания реакций от природы металла и кислоты.