ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Из исходного 0,1 М раствора слабого электролита (кислоты или основания) последовательным разбавлением готовят по 100 мл 0,05 М; 0,025 М; 0,0125 М; 0,00625 М; 0,003 М; 0,0015 М растворов.
Все растворы готовят в мерных колбах на 100мл. Для этого рассчитывают объем V1 исходного раствора кислоты (основания) с молярной концентрацией C1, необходимый для приготовления объема V2 раствора заданной концентрации С2. При расчете исходят из того, что количество кислоты при разбавлении исходного раствора не изменяется:
C1 ·V1 = С2 ·V2.
V1 = С2 ·V2 / C1.
Например, для приготовления 100мл 0,05М раствора необходимо взять 50 мл исходного раствора: V1 = 0,05·100/0,1 = 50 мл.
Для получения более точных результатов концентрации приготовленных растворов устанавливают кислотно-основным титрованием (титруют раствором щелочи или кислоты соответствующей концентрации). Для титрования выбирают раствор щелочи с концентрацией, примерно равной концентрации титруемого раствора.
СН к = (СН NаОН VNаОН)/ VК ,
где СН NаОН – эквивалентная (нормальная) концентрация щелочи, моль/л;
СН к– эквивалентная (нормальная) концентрация кислоты, моль/л;
VNаОН– средний объем щелочи, пошедший на титрование пробы кислоты, мл;
VК– объем пробы кислоты, мл.
Для одноосновных кислот (и однокислотных оснований) эквивалентные и молярные концентрации совпадают СН = СМ.
Результаты титрования заносят в таблицу 5.
Таблица 5 − Результаты титрования
| № п/п | Заданная концен-трация раствора, моль/л | Концен- трация щелочи, моль/л | Объем пробы, мл | Объем щелочи, пошедший на титрование | Средний объем щелочи, мл | Точная концен- трация кислоты, моль/л |
Измеряют электрическую проводимость приготовленных растворов в порядке возрастания концентраций. Перед измерением сосуд и датчик промывают дистиллированной водой и исследуемым раствором. Объем раствора должен быть постоянным, например, 50 мл.
Используя значения удельной электрической проводимости æС, рассчитывают молярную электрическую проводимость по формуле:
lС = æс / CM,
где размерность молярной концентрации [СM] = кмоль/м3 (1 кмоль/м3 соответствует 1 моль/л).
Вычисляют степень электролитической диссоциации a по формуле:
a = lС / l0,
используя экспериментальные значения lС и справочные значения l0.
Молярную электропроводность раствора электролита при бесконечном разведении l0 рассчитывают по закону независимости движения ионов. Молярные электрические проводимости ионов при бесконечном разведении λ0+ и λ0– берут из таблицы Приложения «Молярные электрические проводимости ионов при бесконечном разведении» [2].
Константу диссоциации рассчитывают по закону разведения Оствальда:
КДИС =  .
.
Константу диссоциации можно рассчитать по формуле:
КДИС =  . (*)
. (*)
Результаты измерений и вычислений оформляют в виде таблицы 6.
Таблица 6 – Результаты измерений электропроводности слабого электролита
| № п/п | Точная концен-трация раствора, кмоль/м3 | Удельная электро-проводность раствора æС, Ом -1 ∙ м -1 | Молярная электропровод-ность раствора lС, Ом -1 ∙ м 2∙кмоль-1 | Степень диссо- циации aС | КДИС |
Полученное значение КДИС сравнивают со справочным значением из таблицы Приложения «Константы диссоциации слабых кислот и оснований при 25°C» [2], вычисляют абсолютную (∆) и относительную (δ) погрешность определения КДИС.
∆ = | КДИС(ТАБЛ) – КДИС(ЭКСП) |;
Δ =  ·100%.
·100%.
По результатам измерений и расчетов строят графики (рис. 6) зависимостей lС = f (СM), a = (СM), делают выводы.


а) б)
Рис.6 – Зависимость молярной электропроводности раствора слабого электролита (а) и степени диссоциации слабого электролита (б) от 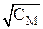 .
.
Константу диссоциации слабого электролита КДИС и его молярную электропроводность l0 при бесконечном разведении можно определить графическим методом. Для этого необходимо преобразовать уравнение (*).
КДИС ∙l0∙(l0 − lС ) = СМ∙lС 2;
КДИС ∙l02 − КДИС ∙l0∙lС = СМ∙lС 2.
Правую и левую части уравнения делят на lС:
КДИС ∙l02/lС − КДИС ∙l0 = СМ∙lС ;
СМ∙lС = − КДИС ∙l0 + КДИС ∙l02/lС;
Так как СМ∙lС = æс , то æс = − КДИС ∙l0 + КДИС ∙l02/lС.
По экспериментальным данным строят график зависимости æс = f(1/lС) (рис.7).
Отрезок, отсекаемый на оси ординат, равен −КДИС∙l0, а отрезок, отсекаемый на оси абсцисс, равен 1/l0. Действительно, если æс = 0, то − КДИС ∙l0 + КДИС ∙l02/lС = 0 и l0 = lС (1/l0 = 1/lС).

Рис.7 – График зависимости æс = f(1/lС).