Поверхностная энергия и её анизотропия. Поверхностное натяжение
Устойчивые конденсированные тела самопроизвольно не распадаются на части. С физической точки зрения причиной устойчивости является необходимость совершить работу для образования новых поверхностей раздела. Таким образом, энергия тела, имеющего более протяженную границу с окружающей средой, оказывается больше, чем тела, имеющего менее протяженную границу. Эту дополнительную энергию относят к площади поверхности тела и называют поверхностной энергией.
В равновесии тело должно принять такую форму, при которой поверхностная энергия минимальна. Для жидкостей это требование сводится к минимальности площади поверхности при заданном объеме тела. Как известно из математики, наименьшую поверхность при заданном объеме имеет шар, поэтому любой конечный объем жидкости в свободном состоянии должен принять форму шара.
Твердые кристаллические тела имеют более сложную равновесную форму, так как поверхностные энергии различных кристаллографических граней не одинаковы. В этом случае минимум поверхностной энергии достигается не при минимальной общей площади поверхности, а при такой форме, которая обеспечивает большую долю для тех кристаллографических граней, которые обладают меньшей поверхностной энергией. Если зависимость поверхностной энергии от направления в кристалле известна, то равновесную форму кристалла можно получить с помощью построения Вульфа. Из произвольной точки, принятой за центр кристалла, во всех направлениях откладываются отрезки, пропорциональные поверхностной энергии тех плоскостей, которые перпендикулярны данному направлению. Затем строится внутренняя огибающая поверхность всех таких плоскостей, проведенных через концы соответствующих отрезков. Если одна из граней кристалла имеет поверхностную энергию намного меньшую, чем другие грани, то почти вся поверхность кристалла (за исключением небольших закруглений вблизи ребер) будет образована именно такими гранями. Хорошим примером являются кубические кристаллы поваренной соли, у которых все шесть граней образованы плоскостями, имеющими одинаковое строение и обладающими наименьшей поверхностной энергией. Форма реальных кристаллов не всегда совпадает с телом, полученным описанным выше способом, так как рост кристаллов часто происходит в условиях очень далеких от равновесных. В этом случае на форме кристалла сказывается не только величина поверхностной энергии той или иной грани, но и скорость доставки к ней материала для роста.
Во взаимодействии любой системы со своим окружением преимущественно участвуют те частицы, которые находятся вблизи поверхности. Относительное количество таких частиц невелико по сравнению с их полным числом в системе и быстро падает с увеличением ее размеров. Следовательно, для системы больших размеров энергия ее взаимодействия с внешним окружением пренебрежимо мала по сравнению с внутренней энергией. Это позволяет с достаточной точностью считать энергию всей системы равной сумме энергий ее частей. Свойство аддитивности экстенсивных характеристик системы начинает нарушаться при уменьшении размеров входящих в нее частей, когда становятся сравнимыми количества «приповерхностных» и «объемных» частиц, например, для систем, содержащих, зародыши новой фазы, адсорбированные поверхностью частицы, мелкодисперсные частицы в коллоидных средах и т.д.
Состояние частицы (молекулы, атома, иона) в приповерхностном слое конденсированной фазы отличается от состояния той же частицы внутри объема этой фазы. В последнем случае любые парные взаимодействия между частицами уравновешены аналогичными взаимодействиями со стороны других соседних частиц, что и определяет минимум свободной энергии в объеме фазы. В отличие от этого у частицы, находящейся на границе раздела фаз, взаимодействия со своими соседями не уравновешены по всем направлениям из-за различия физических свойств смежных фаз. Это приводит к тому, что в межфазном (приповерхностном) слое возникает дополнительное поле межмолекулярных (межатомных или межионных) сил, изменяющее термодинамические свойства этого слоя по отношению к объемным свойствам смежных фаз. Возникающие изменения проявляются двояко: во-первых, в дополнительном силовом поле запасается избыточная поверхностная (или межфазная) энергия, характеризуемая поверхностным натяжением σ; во-вторых, это поле изменяет концентрацию частиц в поверхностном (межфазном) слое.

|
| Рис. 1. К выводу поверхностных термодинамических соотношений. Штрих-пунктирная линия соответствует резкой межфазной границе в отсутствие переходного слоя |
Для выяснения физического смысла новой термодинамической величины σ будем следовать Гиббсу, который предложил рассматривать межфазный переходной слой, показанный, в качестве самостоятельной фазы, термодинамические свойства которой отличаются от свойств смежных объемных фаз I и II. В частности, отличаются внутренняя энергия U, свободная энергия F, энтропия S и число молей n для каждого i-го компонента.
Эти отличия задаются в виде соответствующих избытков:
ΔU = U-(UI+UII), ΔF = F - (FI+FII),
ΔS = S-(SI + SII), Δni = ni - (niI + niII)
где верхние индексы I и II характеризуют значения величин в объемах VI и VII, занимаемых фазами I и II до возникновения на их месте межфазного слоя (см. рис.1.).
Следовательно, объем переходного слоя равен V = VI + VII, тогда:
ΔV = V-(VI+VII)=0
Поверхностное натяжение вводится как удельная поверхностная энергия:
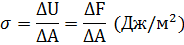
где 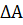 - изменение площади поверхности раздела.
- изменение площади поверхности раздела.
Поверхностное натяжение (  ) возникает на границе раздела фаз, оно является центральным понятием физики и химии поверхностных явлений и их важнейшей характеристикой. Поскольку молекулы, находящиеся в поверхностном слое, имеют избыточную энергию, то для образования новой поверхности требуется совершить работу. Поэтому величина
) возникает на границе раздела фаз, оно является центральным понятием физики и химии поверхностных явлений и их важнейшей характеристикой. Поскольку молекулы, находящиеся в поверхностном слое, имеют избыточную энергию, то для образования новой поверхности требуется совершить работу. Поэтому величина  может быть интерпретирована как работа обратимого изотермического образования единицы поверхности раздела фаз. Другое определение поверхностного натяжения рассматривает его как избыточную тангенциальную силу на единицу длины периметра поверхности.
может быть интерпретирована как работа обратимого изотермического образования единицы поверхности раздела фаз. Другое определение поверхностного натяжения рассматривает его как избыточную тангенциальную силу на единицу длины периметра поверхности.
Не скомпенсированность сил, действующих на молекулы (ионы, атомы) в поверхностном слое, вызывает появление результирующей силы P, направленной в сторону той фазы, в которой силы межмолекулярного взаимодействия больше. P часто называют внутренним давлением. Чтобы переместить молекулу из объема фазы на поверхность, надо совершить работу против этого внутреннего давления.
Поверхностное натяжение – основная термодинамическая характеристика поверхностного слоя жидкости на границе с газовой фазой или другой жидкостью.
Поверхностное натяжение зависит от температуры. Для многих однокомпонентных неассоциированных жидкостей вдали от критической температуры хорошо выполняется линейная зависимость:
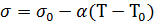
где  и
и  – поверхностное натяжение при температурах Т и
– поверхностное натяжение при температурах Т и  соответственно; величина a– температурный коэффициент поверхностного натяжения. При критической температуре исчезает различие между жидкостью и ее паром, и поверхностное натяжение становится равным нулю.
соответственно; величина a– температурный коэффициент поверхностного натяжения. При критической температуре исчезает различие между жидкостью и ее паром, и поверхностное натяжение становится равным нулю.
Поверхностное натяжение непосредственно можно измерить только в условиях обратимого изменения поверхности раздела фаз, т. е. при достаточной подвижности этой поверхности, например, на границах жидкость-пар или жидкость-жидкость при не слишком высокой вязкости жидкостей.
С точки зрения термодинамики поверхностное натяжение определяется как частная производная любого термодинамического потенциала по площади поверхности раздела фаз при постоянстве естественных переменных и числа молей компонента.
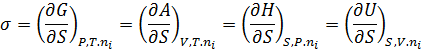
Для плоской поверхности  представляет собой избыточную энергию Гиббса:
представляет собой избыточную энергию Гиббса:
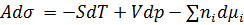
единицы поверхности:

 - избыточное количество молей i-того компонента на единицу поверхности межфазного слоя;
- избыточное количество молей i-того компонента на единицу поверхности межфазного слоя;  – избыточная энтропия и объем на единицу поверхности межфазного слоя.
– избыточная энтропия и объем на единицу поверхности межфазного слоя.
При постоянных  :
:

Для двухкомпонентных систем:
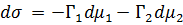
Где 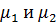 связаны уравнением Гиббса-Дюгема
связаны уравнением Гиббса-Дюгема
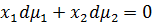
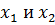 - мольные фракции двух компонент
- мольные фракции двух компонент
Следовательно,
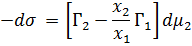
Применим выражение для химического потенциала (для растворов) в случаи адсорбции второго компонента на первом:
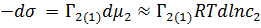
Где  , а
, а 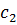 - концентрация второго компонента.
- концентрация второго компонента.
Отсюда 
где  – коэффициент активности второго компонента.
– коэффициент активности второго компонента.

|
| Рис.2. Изменение поверхностного натяжения в двухкомпонентной системе |
Распределение нескольких сортов атомов на границе определяется суммарным понижением свободной энергии и характеризуется сильным влиянием малых количеств веществ с низким поверхностным натяжением. Эти вещества имеют тенденцию концентрироваться в поверхностном слое, уменьшая поверхностное натяжение.
Для веществ с высоким поверхностным натяжением добавление в поверхностный слой с более низкой поверхностной энергией ведет к уменьшению их концентрации на поверхности и оказывает весьма слабое влияние на поверхностное натяжение.
Для веществ с высокой поверхностной энергией, таких как металлы, влияние поверхностных примесных атомов очень велико. Например, кислород и сера могут понизить поверхностное натяжение жидкого железа от 1,84 до 1,2 Н/м при добавлении всего 0,05 %.