Опыт 1. Получение метана и изучение его свойств
Реактивы и материалы: уксуснокислый натрий, обезвоженный; натронная известь; бромная вода, насыщенный раствор; перманганат калия, 1 н. раствор. Оборудование: газоотводная трубка.
1. Получение метана и его горение.
В сухую пробирку 1, снабженную пробкой с газоотводной трубкой (рис. 1), помещают смесь из обезвоженного уксуснокислого натрия и натронной извести (смеси едкого натра и оксида кальция в отношении 1:2 для предотвращения разрушения стекла щелочью) (высота слоя 6— 10 мм). Затем укрепляют пробирку горизонтально и нагревают смесь в пламени горелки.
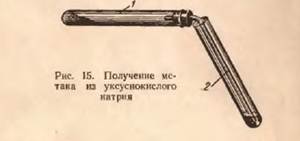
Рис 1. Прибор для получения метана
При нагревании натриевой соли уксусной кислоты с натронной известью происходит расщепление соли с образованием метана. Нагревание натриевых солей карбоновых кислот с натронной известью является общим лабораторным способом получения предельных углеводородов.
Химизм процесса: CH3COONa+ NaOH → СН4↑ + Na2CО3
Поджигают выделяющийся газообразный метан у конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем. Химизм процесса: СН4 + 2О2 → СО2 + 2Н2О
2. Отношение метана к бромной воде и перманганату калия.
В пробирку 2 помещают 5 капель раствора перманганата калия и в пробирку 3 — 5 капель бромной воды. Не прекращая нагревания смеси в пробирке 1, вводят поочередно конец газоотводной трубки в пробирки 2 и 3. Обесцвечивания растворов перманганата калия и бромной воды не происходит. В обычных условиях алканы устойчивы к действию окислителей. Реакции замещения у них идут в довольно жестких условиях, к реакциям присоединения алканы не способны.