Алюминий. Характеристика элемента, исходя из его положения в периодической системе, физические свойства, распространение в природе, способы получения, химические свойства.
Алюми́ний — элемент 13-й группы периодической таблицы химических элементов , третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий — лёгкий, парамагнитный металл серебристо-белогоцвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- иэлектропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Современный метод получения, процесс Холла—Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых илиграфитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
Лабораторный способ получения алюминия: восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):

Металл серебристо-белого цвета, лёгкий, плотность — 2,7 г/см³, температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C, высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу. Алюминий обладает высокой электропроводностью (37·106 См/м) и теплопроводностью (203,5 Вт/(м·К)), 65 %, обладает высокой светоотражательной способностью.
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием(силумин).
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре по данным различных исследователей оценивается от 7,45 до 8,14 %. В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений.
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Ar протонами космических лучей с высокими энергиями.
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной пленки можно, добавляя к алюминию такие металлы как галлий,индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов[9].
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия:

с галогенами (кроме фтора)[10], образуя хлорид, бромид или иодид алюминия:

с другими неметаллами реагирует при нагревании:
со фтором, образуя фторид алюминия:

с серой, образуя сульфид алюминия:

с азотом, образуя нитрид алюминия:

с углеродом, образуя карбид алюминия:

Сульфид и карбид алюминия полностью гидролизуются:


Со сложными веществами:
с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):

со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
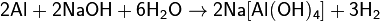

Легко растворяется в соляной и разбавленной серной кислотах:


При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:

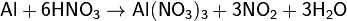
восстанавливает металлы из их оксидов (алюминотермия):


44.Соединения алюминия, их амфотерные свойства
Электронная конфигурация внешнего уровня алюминия … 3s23p1.
В возбужденном состоянии один из s-электронов переходит на свободную ячейку p-подуровня, такое состояние отвечает валентности III и степени окисления +3. Во внешнем электронном слое атома алюминия существуют свободные d-подуровни.
Важнейшие природные соединения – алюмосиликаты:
белая глина Al2O3 ∙ 2SiO2 ∙ 2H2O, полевой шпат K2O ∙ Al2O3 ∙ 6SiO2, слюда K2O ∙ Al2O3 ∙ 6SiO2 ∙ H2O
Из других природных форм нахождения алюминия наибольшее значение имеют бокситы А12Оз ∙ nН2О, минералы корунд А12Оз и криолит А1Fз ∙3NaF.
Легкий, серебристо-белый, пластичный металл, хорошо проводит электрический ток и тепло.
На воздухе алюминий покрывается тончайшей (0,00001 мм), но очень плотной пленкой оксида, предохраняющей металл от дальнейшего окисления и придающей ему матовый вид.
Оксид алюминия А12О3
Белое твердое вещество, нерастворимое в воде, температура плавления 20500С.
Природный А12О3 - минерал корунд. Прозрачные окрашенные кристаллы корунда - красный рубин – содержит примесь хрома - и синий сапфир - примесь титана и железа - драгоценные камни. Их получают так же искусственно и используют для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п.
Химические свойства
Оксид алюминия проявляет амфотерные свойства
1. взаимодействие с кислотами
А12О3 +6HCl = 2AlCl3 + 3H2O
2. взаимодействие со щелочами
А12О3 + 2NaOH – 2NaAlO2 + H2O
Al2O3 + 2NaOH + 5H2O = 2Na[Al(OH)4(H2O)]
3. при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Мп, V, W и др.) в свободном состоянии
2А1 + WO3 = А12Оз + W
4. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза
Al2O3 + Na2CO3 = 2 NaAlO2 + CO2
Гидроксид алюминия А1(ОН)3
А1(ОН)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер.
Получают гидроксид алюминия реакцией обмена растворимых солей алюминия со щелочами
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Al3+ + 3OH- = Al(OH)3↓
Данную реакцию можно использовать как качественную на ион Al3+
Химические свойства
1. взаимодействие с кислотами
Al(OH)3 +3HCl = 2AlCl3 + 3H2O
2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + А1(ОН)з = Na[A1(OH)4]
3. термическое разложение
2Al(OH)3 = Al2О3 + 3H2O
Соли алюминияподвергаются гидролизу по катиону, среда кислая ( рН < 7)
Al3+ + Н+ОН- ↔ AlОН2+ + Н+
Al(NO3)3 + H2O↔ AlOH(NO3)2 + HNO3
Растворимые соли алюминия и слабых кислот подвергаются полному (необратимому гидролизу)
Al2S3+ 3H2O = 2Al(OH)3 +3H2S
Оксид алюминия Al2O3 – входит в состав некоторых антацидных средств (например, Almagel), используется при повышенной кислотности желудочного сока.
КAl(SO4)3 12H2О – алюмокалиевые квасцы применяются в медицине для лечения кожных заболеваний, как кровоостанавливающие средство. А также используют как дубильное вещество в кожевенной промышленности.
(CH3COO)3Al - Жидкость Бурова- 8% раствор ацетата алюминия оказывает вяжущее и противовоспалительное действие, в больших концентрациях обладает умеренными антисептическими свойствами. Применяется в разведенном виде для полоскания, примочек, при воспалительных заболеваниях кожи и слизистых оболочек.
AlCl3 - применяется в качестве катализатора в органическом синтезе.
Al2(SO4)3 · 18 H20 – применяется при очистки воды.