ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
26. Составить таблицу электродных потенциалов алюминия в растворах с активными концентрациями Al3+: 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертить кривую зависимости электродного потенциала от концентрации ионов.
27. Вычислить, как изменится электродный потенциал цинка, если концентрация раствора сульфата цинка, в который погружена цинковая пластинка, уменьшится от 0,1 до 0,01 н.
28. Вычислить ЭДС гальванического элемента Ni/NiSO4||CoSO4/Co,
если [Ni2+]=0,001 моль/л и [Со2+]=0,1 моль/л.
29. Вычислить ЭДС концентрационного элемента, составленного из двух водородных электродов, погруженных в растворы кислот с рН=2 и рН=4.
30. Имеются концентрационные цепи:
а) Ag/0,1 Н AgNO3 || 0,01 Н AgNO3/Ag;
б) Zn/0,0001 г-ион/л Zn2+|| 0,01 г-ион/л Zn2+/Zn
В отношении каждой из этих цепей вычислить электродные потенциалы и ЭДС.
31. Обозначить знаки электродов, указать направление потока электронов и вычислить ЭДС концентрационных цепей:
а) Pt, H2/0,001 Н Hcl || 0,02 M H2SO4/ H2, Pt;
б) Pt, H2/0,00001 Н Hcl || вода/ H2, Pt.
32. Сравнить ЭДС двух концентрационных цепей:
а) Zn/0,01 М ZnSO4 || 0,1 M ZnSO4/Zn;
б) Zn/0,001 М ZnSO4 || 0,01 M ZnSO4/Zn.
33. Указать знаки полюсов, направление потока электронов и ЭДС цепи (под обозначениями концентраций соответствующих растворов указаны степени диссоциации электролитов α):
Ag/0,001 Н AgNO3 || 0,01 Н AgNO3/Ag
α = 1 α = 0,6
34. Дана концентрационная цепь
+Ag/[Ag+] = 0,05 г-ион/л || [Ag+] = х г-ион/л/Ag–
ЭДС цепи Е = 0,118 В. Чему равна концентрация раствора AgNO3 при отрицательном электроде?
35. Имеется концентрационная цепь
+Cu/[Cu2+] = 0,1 г-ион/л || [Cu2+] = х г-ион/л/Cu–
Е - 0,059 В. Определить х.
36. Вычислите ЭДС и изменение энергии Гиббса для гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов (моль/л): С  = 1,8
= 1,8 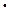 10–5, С
10–5, С 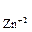 = =2,5
= =2,5 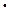 10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
37. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов С 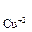 = 1 моль/л, а у другого - 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте исходя из величины ЭДС и
= 1 моль/л, а у другого - 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте исходя из величины ЭДС и 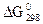 этой цепи.
этой цепи.
38. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ 10–4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
39. Концентрационная гальваническая цепь составлена магниевыми электродами, погруженными в растворы MgSO4 разной концентрации: Mg/2 М MgSO4 || Mg/0,001 Н MgSO4
Кажущаяся степень диссоциации в 0,001 Н MgSO4 равна 87%. Определите степень электролитической диссоциации MgSO4 в 2М растворе, если ЭДС цепи равна 0,103 В.
40. Исходя из величины стандартных окислительно-восстановительных потенциалов и значения 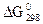 , определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
, определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
а) 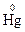 – 2e– = Hg2+;
– 2e– = Hg2+;
б) PbO2 + 4H+ + 2e– = Pb2+ + 2H2O
41. Будет ли работать гальванический элемент, состоящий из водородных электродов, погруженных в 1 Н и 0,1 Н растворы КОН при 250С, если кажущаяся степень диссоциации растворов КОН соответственно равна 77 и 91%?
42. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)?
43. Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
44. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
45. При какой концентрации ионов Cu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?
46. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
47. Гальванические элементы составлены по схемам:
а) Fe3+/Fe2+ || Ag+/Ag;
б) ClO 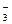 + 6H+/Cl– + 3H2O || 2J–/J2.
+ 6H+/Cl– + 3H2O || 2J–/J2.
Рассчитайте ЭДС этих элементов при стандартных условиях и найдите изменение энергии Гиббса протекающих в них реакций, уравнения которых напишите в ионно-молекулярной и молекулярной формах.
48. Как будет смещаться равновесие в системах при работе составленного из них гальванического элемента:
а) CrO 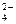 +2H2O/CrO
+2H2O/CrO 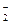 +4OH– и ClO–+2H+/Cl–+H2O;
+4OH– и ClO–+2H+/Cl–+H2O;
б) MnO2+4H+/Mn2++2H2O и NO 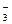 +H2O/NO
+H2O/NO 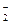 +2OH–.
+2OH–.
Напишите уравнения соответствующих реакций. Определить ЭДС и 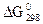 .
.
49. Нормальные потенциалы олова и свинца равны –0,14 В и –0,13 В. Покажет ли амперметр ток в гальваническом элементе, образованном из полуэлементов Sn|Sn2+ Cм = 1 моль/л || Pb2+ Cм= 0,46 моль/л |Pb.
50. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с рН 2 и рН 13? Какова ЭДС этого элемента?