ХИМИЧЕСКАЯ СВЯЗЬ
76. Что называют линией связи и углом связи, или валентным углом? Как называют связь, которая образуется перекрыванием электронных облаков вдоль линии связи? Приведите примеры образования σ-связи.
77. Почему при наличии одной связи между атомами она может быть только σ-связью? При каких условиях образуются π-? Для всех ли форм электронных облаков возможно образование этих связей?
78. Приведите примеры молекул, которые содержат между соседними атомами: а) только σ-связи; б) одну σ- и одну π-связи, в) одну σ- и две π-связи. Сколько σ- и π-связей содержат молекулы: CC14, SO3, C2H4, C2H2?
79. Перечислите возможные типы гибридизации s- и p-орбиталей. В каком из них гибридные орбитали по энергии и форме в наибольшей степени приближаются к исходной s- или p-орбитали?
80. Какие АО не могут участвовать в гибридизации? Возможна ли гибридизация орбиталей: а) 3p- и 4s-; б) 4s- и 5р-; в) 4s- и 4р-; е) 4s-, 4p- и 4d-? Почему?
81. Какое влияние оказывает не поделённая электронная пара на углы между связями? Как это можно объяснить? Почему угол НОН в молекуле Н2О меньше угла HNH в молекуле NH3?
82. Какую связь называют водородной и почему ее образуют только те атомы водорода, которые связаны с атомами наиболее электроотрицательных элементов? Назовите их.
83. Почему для молекул H2S и НС1 в отличие от Н2О и НF образование водородных связей не характерно?
84. Чем объяснить значительно более высокие температуры плавления и кипения воды и фтороводородной кислоты по сравнению с теми, которые должны соответствовать их молярным массам?
85. Покажите схемами два возможных механизма образования ковалентной связи. При какой структуре электронных оболочек атомов возможен тот и другой случай? Влияет ли механизм образования ковалентной связи на ее свойства?
86. Какие атомы или ионы называют донорами и акцепторами электронных пар? Приведите примеры.
87. Кроме таких параметров, как энергия и длина связи, какими тремя свойствами характеризуется ковалентная связь? Что понимается под насыщаемостью ковалентной связи и чем она определяется?
88. Чем объясняется способность многих элементов к образованию числа связей, превышающего число неспаренных электронов в их атомах? Какое состояние атома называют основным и возбужденным? Приведите примеры.
89. Сравните возможности промотирования электронов в атомах азота, кислорода и фтора с теми же возможностями в атомах аналогов по группе, например, фосфора, серы и хлора.
90. Сколько валентных электронов и валентных АО имеют атомы: С и Si; N и Р; О и S? Чему равна максимальная ковалентность элементов 2-го и 3-го периодов?
91. На примере ряда соединений объясните, как влияет на устойчивость гибридного состояния центрального атома плотность гибридизируемых облаков. Ряд соединений: NH3  PH3
PH3  AsH3
AsH3  SbH3.
SbH3.
92. Что такое sр3-гибридизация электронных облаков? Какую пространственную конфигурацию имеют молекулы веществ с таким типом гибридизации? Приведите примеры соответствующих соединений.
93. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HJ, JCl, BrF - наиболее полярна.
94. Распределите электроны атома серы по атомным орбиталям. Сколько неспаренных электронов имеет атом серы в основном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
95. Нарисуйте энергетическую схему образования молекулы He2 и молекулярного иона He 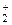 по методу МО и объясните невозможность существования молекулы He2?
по методу МО и объясните невозможность существования молекулы He2?
96. Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите электронные уравнения превращения соответствующих ионов в нейтральные атомы.
97. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях СН4, СН3ОН, НСООН, СО2.
98. Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы и какова их природа?
99. Нарисуйте энергетическую схему образования молекулярного иона Н 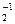 и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему?
и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему?
100. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода?