Рассмотрим несколько примеров электролиза
Электролиз соли меди с растворимым медным анодом Катодом является химически чистая электролитическая медь, а анодом — чер-
новая медь. В качестве электролита применяют водный раствор сульфата меди.
На аноде Сu = Сu 2+ +2е-
На катоде Сu 2+ +2е-=Сu
Этот метод применяется для рафинирования меди и других металлов.
Электролиз водного раствора сульфата натрия с нерастворимыми платиновыми электродами. Сульфат натрия в водном растворе диссоциирует на ионы 2Na+ и SO42-. При электролизе процесс на катоде может быть выражен следующим образом: 4Na+ + 4Н20+4е-=4Na+ 4ОН-+2Н2
или Н20+4е-=4ОН-+2Н2
а на аноде 2SO42- +2Н20-4е-=4Н+ + 2SО42-+O2
или 2Н20-4е-=4Н+ + O2
Таким образом, на катоде выделяется водород, а на аноде кислород; вблизи катода получается гидроокись натрия, а вблизи анода — серная кислота. Если католит (раствор у катода) и анолит (раствор у анода) смешать, то получится сульфат натрия и вода. Таким образом, электролиз водного раствора сульфата натрия сводится к разложению воды на водород и кислород.
Электролиз водного раствора йодида калия с платиновыми электродами. Иодид калия в водном растворе содержит -ионы калия и иодид-ионы.
На катоде 2К++2Н2О+2е-=2К++20Н-+Н2
или 2Н2О+ 2е- = 20Н- + Н2
а на аноде 2J- —2е- = J2
На катоде выделяется водород, а на аноде йод.
Электролиз водного раствора серной кислоты с платиновыми электродами. При электролизе раствора серной кислоты
на катоде 4Н++4e-=2Н2
На аноде 2SO42- +2Н20—4е-=4Н++2SO42- + О2
или 2Н2О—4е- = 4Н++О2
т. е. по существу происходит разложение воды на водород и кислород. В случае если электролитом является кислота с кислородсодержащим анионом или соль такой кислоты, то при электролизе на аноде выделяется кислород и увеличивается концентрация кислоты в анолите,
По активности к окислению на аноде отрицательные ионы могут быть расположены в следующий ряд:
элементарные ионы.. .сложные ионы
J-, Вг-, С1-, S2- ОН-, SO42-, N03-, С1О4- ...
При электролизе водных растворов соединений, содержащих сложные ионы, вместо последних на аноде разряжается гидроксид-ион.
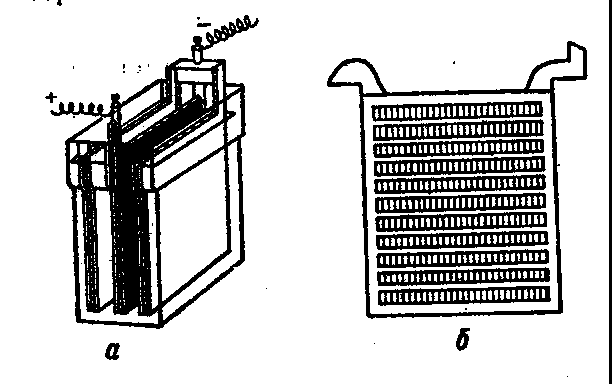
Рис. 7. Свинцовый аккумулятор: а — смонтированный аккумулятор, б — свинцовая пластина