Термодинамика электрохимических систем
Термодинамическая система, в которой происходит взаимное превращение химической и электрической форм энергии, называется электрохимической системой, или электрохимической цепью.
При записи формул электрохимических цепей следует руководствоваться системой обозначений, установленной Международной конвенцией об ЭДС и электродных потенциалах (1953 г., с дополнениями 1973 г.):
· Вертикальная черта ô разделяет две фазы, находящиеся в контакте между собой.
· Запятой отделяются различные ионы или молекулы, сосуществующие в одной и той же фазе (в растворе или расплаве).
· Двойная вертикальная черта ôô обозначает солевой мостик, обеспечивающий контакт между двумя растворами электролитов и устраняющий диффузионный потенциал.
· Символом Pt обозначают индифферентный электрод.
· Запись формулы электрода начинают с фазы раствора. При этом первой указывают окисленную ионную форму. Газовую фазу приводят после жидкой.
· В формуле электрохимической цепи справа размещают электрод с бόльшим значением стандартного электродного потенциала.
· Правильно разомкнутая электрохимическая цепь начинается и заканчивается проводником из одного и того же металла.
Реакции, протекающие на электродах, записывают как процессы восстановления. Сначала приводят уравнение реакции на правом электроде, затем – на левом. Находят наименьшее общее кратное количества электронов, переносимых в элементарных электродных реакциях, и умножают каждое уравнение на соответствующий коэффициент. Вычитая из первого уравнения второе, получают уравнение реакции для электрохимической цепи в целом.
По определению, стандартная ЭДС электрохимической цепи выражается как разность стандартных потенциалов правого и левого электродов:

| (3.1) |
Выражение для ЭДС электрохимической цепи при 25 ºС согласно уравнению Нернста имеет вид:
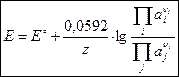 , ,
| (3.2) |
где Е – ЭДС электрохимической цепи при данных активностях ионов;
 – стандартная ЭДС, В;
– стандартная ЭДС, В;
z – количество электронов, переносимых в элементарном электрохимическом акте;
 и
и  – произведения активностей потенциал-определяющих ионов соответственно исходных веществ и продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам при этих веществах в уравнении химической реакции, протекающей в электрохимической цепи;
– произведения активностей потенциал-определяющих ионов соответственно исходных веществ и продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам при этих веществах в уравнении химической реакции, протекающей в электрохимической цепи;
0,0592 В = 2,303 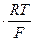 при 25 °С;
при 25 °С;
R = 8,314 Дж/(моль×К) – универсальная газовая постоянная;
F = 96485 Кл/моль – постоянная Фарадея.
Используя уравнение для стандартного химического сродства
| DrG° = –RTlnKа, | (3.3) |
и уравнение, связывающее DG° со стандартной ЭДС,
| DG° = –zFE° , | (3.4) |
получим выражение стандартной ЭДС электрохимической цепи через термодинамическую константу равновесия Ка:
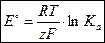
| (3.5) |
Изменение энтропии DrS° в ходе электрохимической реакции связано с температурным коэффициентом ЭДС  уравнением:
уравнением:
DrS° = zF 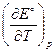
| (3.6) |
Тепловой эффект Qp электрохимической реакции определяется согласно второму началу термодинамики:
| Qp = T×DrS° | (3.7) |
Рассчитав энтропию DrS° и энергию Гиббса DG° химической реакции, можно найти энтальпию DrН° реакции по уравнению Гиббса-Гельмгольца:
| DrH° = DrG° + T×DrS° | (3.8) |
Для обратимо работающей электрохимической цепи максимальная полезная работа W¢max представляет собой максимальную электрическую работу  , которая совершается за счет убыли энергии Гиббса:
, которая совершается за счет убыли энергии Гиббса:
W¢max =  = –(DrG)p,T = z×F×Е = –(DrG)p,T = z×F×Е
| (3.9) |