Примеры решения задач
1 Пользуясь теорией Бора, выведите формулы для потенциальной, кинетической и полной энергии электрона, движущегося по  -й орбите в водородоподобном атоме.
-й орбите в водородоподобном атоме.
 Дано:
Z,
n
Найти:
Un-?
Tn-?
En-? Дано:
Z,
n
Найти:
Un-?
Tn-?
En-?
| Решение
Потенциальная энергия электрона в водородоподобном атоме, порядковый номер которого в Периодической системе элементов Д. И. Менделеева равен Z, определяется электростатическим взаимодействием электрона и ядра, которые можно считать точечными зарядами:
 . (2.10) . (2.10)
|
Здесь  – расстояние между электроном и ядром (радиус
– расстояние между электроном и ядром (радиус  -ой круговой орбиты электрона).
-ой круговой орбиты электрона).
Кинетическая энергия электрона определяется по формуле
 , (2.11)
, (2.11)
где  – скорость электрона на
– скорость электрона на  - ой орбите.
- ой орбите.
Для того, чтобы определить радиус 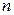 - й орбиты и скорость электрона
- й орбиты и скорость электрона  , необходимо решить систему из уравнений (2.3), (2.4):
, необходимо решить систему из уравнений (2.3), (2.4):
 ,
,
 .
.
Получим:
 , (2.12)
, (2.12)
 . (2.13)
. (2.13)
Подставляя (2.12) в формулу (2.10), а (2.13) – в формулу (2.11), получим следующие выражения для потенциальной и кинетической энергии электрона, движущегося по 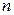 -й орбите:
-й орбите:
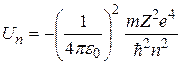 , (2.14)
, (2.14)
 . (2.15)
. (2.15)
Суммируя (2.14) и (2.15), получим выражение для полной энергии электрона, находящегося в 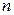 -м стационарном состоянии:
-м стационарном состоянии:
 .
.
Ответы: 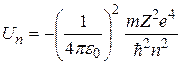 ,
,  ,
,
 .
.
Дано:
Eф=16,5 эВ =26,4·10-19 Дж
 n=1
n=1
| Решение
Для того чтобы определить скорость выбитого из атома электрона, воспользуемся законом сохранения энергии для рассматриваемого явления. Получив энергию Eф,электрон, находящийся в невозбужденном состоянии (n=1) атома водорода (  ), преодолеет притяжение с ядром, т.е. потратит энергию ), преодолеет притяжение с ядром, т.е. потратит энергию  и, покинув атом, приобретет кинетическую энергию и, покинув атом, приобретет кинетическую энергию 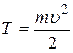 : :
|
Найти:
 -? -?
|
2Фотон с энергией 16,5 эВ выбил электрон из невозбужденного атома водорода. Какую скорость будет иметь электрон вдали от ядра атома?
 (2.16)
(2.16)
В соответствии с теорией Бора энергия водородоподобной системы в n-м стационарном состоянии определяется по формуле (2.6). При условиях  , n=1 она приобретает вид
, n=1 она приобретает вид
 .
.
Затратив энергию связи, электрон станет свободным, т.е. его энергия станет равной нулю. Следовательно,
 . (2.17)
. (2.17)
Подставляя (2.17) в формулу (2.16) и выражая затем скорость, получим:
 .
.
В результате вычислений определим значение скорости электрона:  1,01·106 м/с.
1,01·106 м/с.
Ответ:  1,01·106 м/с.
1,01·106 м/с.
2 Атомарный водород возбуждают на n-й энергетический уровень. Определить длины волн испускаемых линий, если n = 4; каким сериям принадлежат эти линии?
Дано:
 n =4
n =4
| Решение Различные атомы водорода, находящиеся в зоне возбуждения и переведенные в возбужденное состояние с n = 4, могут вернуться в основное состояние (n = 1), совершая последовательность различных квантовых переходов. |
Найти:  -? -?
|
Воспользуемся схемой энергетических уровней, изображенной на рисунке 2.1, и укажем все возможные последовательности квантовых переходов, совершая которые атомы водорода могут перейти с возбужденного уровня (n = 4) на основной (n = 1):
а) 4→3; 3→2; 2→1;
б) 4→2; 2→1;
в) 4→3; 3→1;
г) 4→1.
Выпишем неповторяющиеся квантовые переходы:
4 → 3 (  ); 3 → 2 (
); 3 → 2 (  ); 2 → 1(
); 2 → 1(  ) ;
) ;
4 → 2 (  ); 3 → 1 (
); 3 → 1 (  ); 4 → 1 . (
); 4 → 1 . (  ) . (2.18)
) . (2.18)
Выразим длины волн спектральных линий, соответствующих всем указанным квантовым переходам, пользуясь обобщенной формулой Бальмера (2.1) и связью между волновым числом и длиной волны излучения  :
:
 ;
;  ;
;  .
.
(2.19)
Длины волн  ,
,  ,
,  выразим, применяя комбинационный принцип Ритца:
выразим, применяя комбинационный принцип Ритца:
 ;
;  ;
;
 . (2.20)
. (2.20)
Вычислим значений длин волн  ,
,  ,
, 
 ,
,  ,
,  по формулам (2.19), (2.20), учитывая значение постоянной Ридберга (
по формулам (2.19), (2.20), учитывая значение постоянной Ридберга (  м-1).
м-1).
Получим:  м.
м.
Устанавливая соответствие спектральных линий различным квантовым переходам (2.18) определим, что спектральная линия с длиной волны  м относится к серии Пашена; линии с длинами волн
м относится к серии Пашена; линии с длинами волн  м и
м и  м – серии Бальмера;
м – серии Бальмера;  м,
м,  м и
м и  м – серии Лаймана.
м – серии Лаймана.
Ответ:  м (серия Пашена);
м (серия Пашена);  м,
м,  м (серия Бальмера);
м (серия Бальмера);  м,
м,  м,
м,  м (серия Лаймана).
м (серия Лаймана).