Электродные потенциалы и электродвижущие силы
При решении задач этого раздела см. таблицу 8. Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Ме + m Н2О ® Ме(H2O)mn + nē ,
в растворе на металле
где п - число электронов, принимающих участие в процессе.
На границе металл - жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях - так называемые стандартные электродные потенциалы (Е0).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 250 С условно принимается равным нулю (Е0 = 0; DG0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е0), получаем так называемый ряд напряжений. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е0, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае DG0<0, так как DG0 = -n F E0.
Таблица 8 Стандартные электродные потенциалы (Е0) некоторых металлов
(ряд напряжений)
| Электрод | Е0, В | Электрод | Е0, В |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg22+/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (таблица 8). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта - в растворе с концентрацией 0,1 моль/л.
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
 Е = Е0 +
Е = Е0 +  lgC ,
lgC ,
где Е0 - стандартный электродный потенциал;
n - число электронов, принимающих участие в процессе;
С - концентрация (при точных вычислениях - активность) гидратированных ионов металла в растворе, моль/л;
Е0 для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:

Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи решаются также на основании уравнения Нернста (см. пример 1):
2,41 = - 2,37 +  lgC
lgC
- 0,04 = 0,0295 lg C,
lgC = - 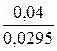 = -1,3559
= -1,3559
С Mg2+ = 4,4×10 –2 моль/л.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнения окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента:
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 -2ē = Mg 2+ (1)
Цинк, потенциал которого -0,763 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn 2+ + 2 ē = Zn 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Zn 2+ = Mg 2+ + Zn 0
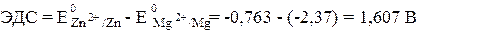 |
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
9.1 Контрольные вопросы
161. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй - серебряную. В каком сосуде цвет раствора постепенно пропадет? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
162. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) СuSO4; б) МgSO4; в) Рb(NО3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
163. При какой концентрации Zn 2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
Ответ: 0,30 моль/л.
164. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) АgNО3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
165. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn 2+ (в моль/л). Ответ: 1,89×10 -2 моль/л.
166. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)? Ответ: 0,20 моль/л.
167. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 B.
168. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
169. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89×10 -12 моль/л.
170. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н, а второй - в 0,1 н растворы АgNO3.
Ответ: 0,059 В.
171. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля.
Ответ: 0,0295 В.
172. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Мg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
173. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
174. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
175. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
176. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3×10 -15 моль/л.
177. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, а [Рb2+] = 0,0001 моль/л. Ответ: 0,064 В.
178. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
179. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
180. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?