Первый закон термодинамики. Внутренняя энергия. Работа и теплота. Теплоемкость.
Внутренняя энергия
Внутренняя энергия системы включает в себя:
кинетическую энергию поступательного, вращательного и колебательного движения частиц;
потенциальную энергию взаимодействия частиц;
энергию электронных оболочек атомов;
внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности. Величина и=U/М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
 ;
;  ;
;  .
.
Ее изменение в термодинамическом процессе 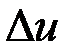 не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
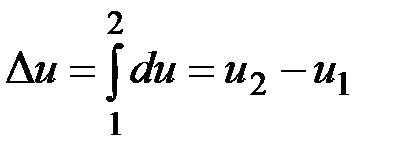 ;
;
 — значение внутренней энергии в начальном состоянии, а
— значение внутренней энергии в начальном состоянии, а  — в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
— в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то

Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления  , аопределяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
, аопределяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:

Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международым соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов — при 0 °С вне зависимости от давления.