Квантовая теория строения атомов. Спин микрочастиц
Параллельно развитию представлений о корпускулярно-волновом дуализме материи в физике развивалось другое направление, также способствовавшее созданию квантовой механики. Речь идет о теории строения атомов. В результате опытов Э. Резерфорда (англ., Нобелевская премия по химии 1908 г.) по рассеянию  -частиц атомами металлической пленки (1911 г.) в физике была принята планетарная модель строения атома. Согласно этой модели, в центре атома находится маленькое положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг ядра по орбитам вращаются отрицательно заряженные электроны.
-частиц атомами металлической пленки (1911 г.) в физике была принята планетарная модель строения атома. Согласно этой модели, в центре атома находится маленькое положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг ядра по орбитам вращаются отрицательно заряженные электроны.
Атомные ядра элемента с порядковым номером Z в таблице Менделеева имеют заряд 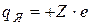 , где e=1.6·10-19 Кл – так называемый элементарный заряд. Вокруг ядра в таком атоме движутся Z электронов, общий заряд которых
, где e=1.6·10-19 Кл – так называемый элементарный заряд. Вокруг ядра в таком атоме движутся Z электронов, общий заряд которых  компенсирует заряд ядра, и в целом атом электронейтрален.
компенсирует заряд ядра, и в целом атом электронейтрален.
Размеры атома ~10-10 м, а размеры ядра ~10-15 м, то есть ядро примерно в 100 000 раз меньше атома. Однако масса ядра в несколько тысяч раз больше суммарной массы электронов, движущихся вокруг ядра.
Однако эта модель противоречила классической физике. Согласно классической электродинамике, вращающийся по орбите электрон должен излучать электромагнитную волну, следовательно, терять энергию и через малое время упасть на ядро, чего в действительности не происходит.
Стремясь разрешить это противоречие, Н. Бор (Нобелевская премия 1922 г.) в 1913 г. создал свою теорию строения простейших (водородоподобных) атомов и ионов, имеющих единственный электрон, в которой он идею Планка о квантовании энергии попытался применить в атомной физике. Он постулировал, что существуют определенные, так называемые стационарные орбиты, двигаясь по которым вокруг ядра, электрон не излучает и не поглощает энергии. Каждой из стационарных орбит соответствует определенное значение энергии электрона 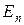 (n=1, 2, 3, ... - номер орбиты).
(n=1, 2, 3, ... - номер орбиты).
По правилу квантования орбит, предложенному Бором, стационарными являются те орбиты, при движении по которым момент импульса  электрона относительно оси его вращения по орбите (о моменте импульса см. подраздел 6.2) принимает значения, кратные постоянной Планка
электрона относительно оси его вращения по орбите (о моменте импульса см. подраздел 6.2) принимает значения, кратные постоянной Планка  :
:
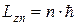 , (9.11)
, (9.11)
где n=1, 2, ... - номер орбиты.
Используя правило квантования орбит и классическую методику расче-
та движения электрона вокруг ядра под действием силы Кулона, Бор рассчитал значения энергии 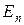 , которые может иметь электрон в простейших атомах и ионах
, которые может иметь электрон в простейших атомах и ионах
 , (9.12)
, (9.12)
где Z - порядковый номер элемента в таблице Менделеева,  =13.6 эВ - энергия ионизации атома водорода (1 эВ = 1.6·10-19 Дж - электронвольт), смысл знака «-» в выражении для энергии объяснен в подразделе 6.3.
=13.6 эВ - энергия ионизации атома водорода (1 эВ = 1.6·10-19 Дж - электронвольт), смысл знака «-» в выражении для энергии объяснен в подразделе 6.3.
Из формулы (9.12) следует, что при увеличении n энергия  увеличивается (но уменьшается по модулю), а при
увеличивается (но уменьшается по модулю), а при 
 .
.
По второму постулату Бора при скачкообразном (квантовом) переходе электрона с одной орбиты на другую испускается или поглощается квант энергии. Пусть электрон переходит с орбиты номер n , где его энергия была равна  , на орбиту номер m, где его энергия станет равна
, на орбиту номер m, где его энергия станет равна  . Если
. Если  (переход «сверху - вниз»), то
(переход «сверху - вниз»), то  , и при переходе испускается квант с энергией
, и при переходе испускается квант с энергией
 . (9.13)
. (9.13)
Из (9.12) и (9.13) следует, что частота излучения, испускаемого при таком переходе, определяется по следующей формуле (обобщенной формуле Бальмера):
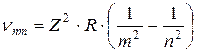 . (9.14)
. (9.14)
где R=3.29∙1015 Гц - постоянная Ридберга.
Если же  (переход «снизу - вверх»), то
(переход «снизу - вверх»), то  , и для перехода требуется поглощение кванта энергии
, и для перехода требуется поглощение кванта энергии
 , (9.15)
, (9.15)
то есть излучения с частотой
 (9.16)
(9.16)
Расчетные значения частот отлично соответствовали данным экспериментов по изучению спектров излучения простейших атомов и ионов, что подтверждало правильность теории Бора.
Принципиально важным моментом теории Бора является идея о квантованности таких физических величин как энергия и момент импульса. Если в классической механике энергия и момент импульса тела в принципе могут изменяться непрерывно и принимать любые значения от нуля до очень больших величин, то в квантовой механике эти же величины для электрона, вращающегося вокруг ядра, могут принимать только некоторые, «разрешенные» значения, каждое из которых соответствует движению по определенной орбите. Такие величины, которые могут принимать только определенные дискретные разрешенные значения, называются квантованными, а совокупность этих разрешенных значений называется спектром значений данной величины. Например, набор разрешенных значений энергии 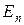 образует энергетический спектр электрона в атоме.
образует энергетический спектр электрона в атоме.
На рисунке 9.3 показан энергетический спектр атома водорода (четыре нижних уровня) и некоторые из возможных квантовых переходов. Разделение уровней на подуровни (кроме первого) объясняется в изложенной далее квантовой теории.
Рисунок 9.3 - Энергетический спектр атома водорода. Показаны первые четыре уровня и некоторые из разрешенных переходов: излучательные - обычными стрелками, поглощательные - двойными.
Однако теория Бора была внутренне противоречива, поскольку сочетала в себе элементы новой теории (квантование орбит, испускание и поглощение квантов энергии) с приемами классической механики (электрон рассматривался как материальная точка, движущаяся по траектории вокруг ядра под действием силы электрического притяжения). Полностью непротиворечивую теорию строения атомов можно создать только путем последовательного применения квантовой механики.
Для этого необходимо с помощью уравнения Шредингера, используя в нем формулу (6.21) потенциальной энергии взаимодействия электрона и ядра, определить волновые функции электронов, движущихся в электрическом поле положительно заряженного ядра. Эта задача точно решается только для водородоподобных атомов и ионов, у которых вокруг ядра движется единственный электрон (атом H, ионы He+, Li2+). Для более сложных атомов и ионов с двумя и более электронами получены приближенные решения.
Основные результаты квантовой теории строения атомов таковы.
Одноэлектронный атом может находиться в определенных квантовых состояниях, каждому из которых соответствует своя  -функция, то есть свое пространственное распределение плотности вероятности нахождения электрона. Состояние электрона, то есть вид
-функция, то есть свое пространственное распределение плотности вероятности нахождения электрона. Состояние электрона, то есть вид  -функции, определяется тремя целочисленными параметрами, называемыми квантовыми числами. Главное квантовое число n принимает значения 1, 2, 3 ..., орбитальное квантовое число l при заданном значении n принимает значения 0, 1, ...
-функции, определяется тремя целочисленными параметрами, называемыми квантовыми числами. Главное квантовое число n принимает значения 1, 2, 3 ..., орбитальное квантовое число l при заданном значении n принимает значения 0, 1, ... 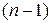 , магнитное квантовое число m при заданном значении l принимает значения
, магнитное квантовое число m при заданном значении l принимает значения 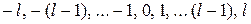 .
.
Для одноэлектронных атомов и ионов их энергия в каждом из возможных состояний определяется только главным квантовым числом. Эти разрешенные значения энергии 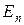 определяются по формуле (9.12), полученной еще в рамках теории Бора. Главное квантовое число n квантовой теории оказалось аналогом номера орбиты в теории Бора.
определяются по формуле (9.12), полученной еще в рамках теории Бора. Главное квантовое число n квантовой теории оказалось аналогом номера орбиты в теории Бора.
Орбитальное квантовое число l определяет численное значение орбитального момента импульса электрона:
 , (9.17)
, (9.17)
а магнитное число m определяет проекцию вектора орбитального момента импульса на некоторое направление в пространстве (ось OZ), то есть момент импульса относительно оси OZ:
 . (9.18)
. (9.18)
Некоторые расхождения теории и эксперимента привели к выводу, что электрон, кроме момента импульса, обусловленного вращением по орбите, должен обладать собственным моментом импульса, названным спином (от англ. spindle - веретено). Аналогично Земле, вращающейся по орбите вокруг Солнца и при этом вращающейся вокруг собственной оси, электрон также движется вокруг ядра и при этом как бы вращается вокруг собственной оси.
Подобно орбитальному моменту импульса, проекция спина  на ось OZ также может принимать не любые, а только разрешенные значения:
на ось OZ также может принимать не любые, а только разрешенные значения:
 , (9.19)
, (9.19)
где  - магнитное спиновое квантовое число, которое для электрона может принимать только два значения
- магнитное спиновое квантовое число, которое для электрона может принимать только два значения  =
= 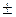 1/2.
1/2.
Таким образом, состояние электрона в атоме можно охарактеризовать, задав значения четырех квантовых чисел: 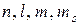 .
.
В многоэлектронных атомах состояние каждого из электронов также характеризует набор значений четырех квантовых чисел 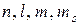 , причем значения, которые могут принимать эти квантовые числа, определяются теми же правилами, что и для одноэлектронного атома.
, причем значения, которые могут принимать эти квантовые числа, определяются теми же правилами, что и для одноэлектронного атома.
Отметим, что представление о спине частиц как вращении вокруг собственной оси является упрощенным, используемым лишь для пояснения этого понятия. В действительности спин - собственный момент импульса частицы - является специфическим свойством микрочастиц, не имеющим прямых аналогий в макромире. Кроме электрона спином обладают многие другие частицы, в том числе – фотоны. Численное значение проекции спина микрочастицы  может быть равно нулю, целому (1, 2, 3) или полуцелому (1/2, 3/2) числу квантов действия
может быть равно нулю, целому (1, 2, 3) или полуцелому (1/2, 3/2) числу квантов действия 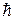 .
.
Электроны и другие частицы с полуцелым спином относятся к классу частиц, называемых фермионами. Для фермионов справедлив принцип В. Паули, установленный в 1924-25 гг. (Нобелевская премия 1945 г.): в любой квантовой системе, например - в атоме, не может быть двух и более фермионов, находящихся в одинаковых состояниях, определяемых набором одинаковых значений всех четырех квантовых чисел.
С помощью принципа Паули объясняется распределение электронов по состояниям в многоэлектронных атомах, а тем самым объясняются химические свойства атомов, о чем будет рассказано в главах, посвященных основам химии.