Реальные газы. Фазовые равновесия и превращения
1. Реальный газ – это газ:
а) свойства которого не зависят от взаимодействия частиц и их собственного объема;
б) свойства которого зависят от взаимодействия частиц и их собственного объема;
в) свойства которого зависят от взаимодействия частиц и их собственного объема, что особенно проявляется при высоких давлениях и низких температурах;
г) свойства которого не зависят от взаимодействия частиц и их собственного объема, что особенно проявляется при высоких давлениях и низких температурах.
2. Уравнение состояния реальных газов (уравнение Ван-дер-Ваальса) для произвольной массы газа имеет вид:
а) 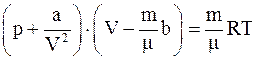 ;
;
б)  ;
;
в)  ;
;
г)  .
.
3. С учётом только поправки на собственный объем молекул 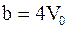 , где
, где  – суммарный собственный объем молекул газа, уравнение состояния реального газа можно записать так (для моля или киломоля):
– суммарный собственный объем молекул газа, уравнение состояния реального газа можно записать так (для моля или киломоля):
а)  ;
;
б) 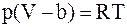 ;
;
в)  ;
;
г)  .
.
4. С учётом поправки на дополнительное (внутреннее) давление, возникающее за счёт межмолекулярного взаимодействия (поправки  ), уравнение состояния реального газа можно записать так (для моля или киломоля):
), уравнение состояния реального газа можно записать так (для моля или киломоля):
а) 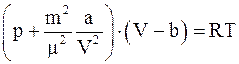 ;
;
б)  ;
;
в)  ;
;
г)  .
.
5. Внутренняя энергия реального газа представляет собой сумму:
а) кинетических энергий поступательного и вращательного движения молекул газа Wk;
б) потенциальной энергии взаимодействия молекул газаWp;
в) сумму кинетических энергий поступательного и вращательного движения молекул газа Wk и потенциальной энергии их взаимодействия Wp.
6. Потенциальная энергия взаимодействия одного моля молекул реального газа:
а) положительна;
б) отрицательна;
в) может быть положительной и отрицательной.
7. Молекулярные силы, создающие внутреннее давление p', являются силами:
а) отталкивания;
б) притяжения;
в) притяжения и отталкивания.
8. Изменение потенциальной энергии реального газа (для моля) равно:
а) работе, которую совершает моль газа при расширении от объёма V1 до V2;
б) работе, которую совершает моль газа, обладающий внутренним давлением p' при сжатии от объёма V1 до V2;
в) работе, которую совершает моль газа, обладающий внутренним давлением p' при расширении от объёма V1 до V2.
9. Изменение потенциальной энергии реального газа (для моля) определяется соотношением:
а) 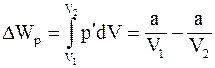 ;
;
б) 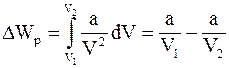 ;
;
в)  ;
;
г)  .
.
10. В некотором приближении кинетическую энергию молекул одного моля реального газа, согласно теореме о равном распределении энергии по степеням свободы, можно определить по формуле:
а)  ;
;
б)  ;
;
в)  ;
;
г)  .
.
11. Внутренняя энергия одного моля реального газа определяется соотношением:
а)  ;
;
б) 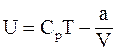 ;
;
в)  ;
;
г)  .
.
12. Изменение температуры реального газа при адиабатическом расширении определяется соотношением:
а)  ;
;
б)  ;
;
в)  ;
;
г)  .
.
13. При адиабатическом расширении реального газа его температура:
а) возрастает;
б) убывает;
в) возрастает или убывает;
г) остаётся величиной постоянной.
14. При адиабатическом сжатии реального газа его температура:
а) возрастает;
б) убывает;
в) возрастает или убывает;
г) остаётся величиной постоянной.
15. Эффект Джоуля-Томсона – это изменение температуры реального газа при расширении через пористую перегородку. При этом, если газ при расширении охлаждается, эффект Джоуля-Томсона называется:
а) отрицательным;
б) положительным;
в) не имеет названия.
16. Эффект Джоуля-Томсона – это изменение температуры реального газа при расширении через пористую перегородку. При этом, если газ при расширении нагревается, эффект Джоуля-Томсона называется:
а) отрицательным;
б) положительным;
в) не имеет названия.
17. Фаза в термодинамике – это:
а) неравновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества;
б) равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества;
в) равновесное состояние вещества, не отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
18. Фазовые превращения – переход вещества из одной фазы в другую:
а) не связанный с качественными изменениями свойств вещества при изменении внешних условий;
б) связанный с качественными изменениями свойств вещества при неизменных внешних условиях;
в) связанный с качественными изменениями свойств вещества при изменении внешних условий.
19. Фазовое равновесие – это:
а) одновременное существование термодинамически равновесных фаз в многофазной системе;
б) не одновременное существование термодинамически равновесных фаз в многофазной системе;
в) одновременное существование термодинамически неравновесных фаз в многофазной системе.
20. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Точка О соответствует равновесию:
| а) одной фазы – твердой; б) двух фаз – твёрдой и жидкой; в) трёх фаз – твёрдой, жидкой и газообразной; г) жидкой и газообразной. | 
|
21. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Точка К соответствует равновесию:
| а) одной фазы – твердой; б) двух фаз – твёрдой и жидкой; в) трёх фаз – твёрдой, жидкой и газообразной; г) жидкой и газообразной фаз. | 
|
22. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Точка В соответствует равновесию:
| а) жидкой и газообразной фаз вещества; б) твёрдой и газообразной фаз вещества; в) твёрдой и жидкой фаз веществ, у которых температура плавления растёт с увеличением давления; г) твёрдой и жидкой фаз веществ, у которых температура плавления уменьшается с увеличением давления. | 
|
23. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Точка В' соответствует равновесию:
| а) жидкой и газообразной фаз вещества; б) твёрдой и газообразной фаз вещества; в) твёрдой и жидкой фаз веществ, у которых температура плавления растёт с увеличением давления; г) твёрдой и жидкой фаз веществ, у которых температура плавления уменьшается с увеличением давления. | 
|
24. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Каждая точка кривой ОА соответствует равновесию:
| а) твердой и газообразной фаз вещества; б) твёрдой и жидкой фаз вещества; в) твёрдой, жидкой и газообразной фаз вещества; г) жидкой и газообразной фаз вещества. | 
|
25. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Каждая точка кривой ОК соответствует равновесию:
| а) твердой и газообразной фаз вещества; б) твёрдой и жидкой фаз вещества; в) твёрдой, жидкой и газообразной фаз вещества; г) жидкой и газообразной фаз вещества. | 
|
26. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Каждая точка кривой ОВ соответствует равновесию:
| а) твердой и газообразной фаз вещества; б) твёрдой и жидкой фаз веществ, у которых температура плавления растёт с увеличением давления; в) твёрдой, жидкой и газообразной фаз вещества; г) жидкой и газообразной фаз вещества. | 
|
27. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Любая точка диаграммы состояния изображает равновесное состояние вещества при данных значениях давления и температуры. Каждая точка кривой ОВ' соответствует равновесию:
| а) твёрдой и жидкой фаз веществ, у которых температура плавления уменьшается с увеличением давления; б) твёрдой и жидкой фаз веществ, у которых температура плавления растёт с увеличением давления; в) твёрдой, жидкой и газообразной фаз вещества; г) жидкой и газообразной фаз вещества. | 
|
28. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Кривые, характеризующие равновесное состояние вещества при данных значениях температуры и давления, делят плоскость диаграммы состояния на области существования каждой из трёх фаз. Область S – это область существования:
| а) твёрдой фазы вещества; б) жидкой фазы вещества; в) газообразной фазы вещества; г) твердой, жидкой и газообразной фаз вещества. | 
|
29. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Кривые, характеризующие равновесное состояние вещества при данных значениях температуры и давления, делят плоскость диаграммы состояния на области существования каждой из трёх фаз. Область L – это область существования:
| а) твёрдой фазы вещества; б) жидкой фазы вещества; в) газообразной фазы вещества; г) твердой, жидкой и газообразной фаз вещества. | 
|
30. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма) – геометрическое изображение равновесных состояний термодинамической системы при разных параметрах состояния, определяющих эти состояния, – даёт информацию о фазовом составе системы в зависимости от параметров состояния. На рисунке 1 представлена одна из возможных диаграмм состояния. Кривые, характеризующие равновесное состояние вещества при данных значениях температуры и давления, делят плоскость диаграммы состояния на области существования каждой из трёх фаз. Область G – это область существования:
| а) твёрдой фазы вещества; б) жидкой фазы вещества; в) газообразной фазы вещества; г) твердой, жидкой и газообразной фаз вещества. | 
|
31. Правило фаз Гиббса: «В веществе, состоящем из n компонентов, одновременно может существовать не более чем:
а) (n + 1) равновесных фаз»;
б) (n + 2) равновесных фаз»;
в) n равновесных фаз»;
г) (n – 1) равновесных фаз».
32. Уравнение Клапейрона-Клаузиуса 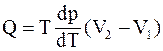 определяет изменение температуры фазового перехода при:
определяет изменение температуры фазового перехода при:
а) любом изменении давления;
б) неизмененном давлении;
в) бесконечно малом изменении давления.
33. Уравнение Клапейрона-Клаузиуса  определяет изменение температуры фазового перехода при:
определяет изменение температуры фазового перехода при:
а) любом изменении давления;
б) неизмененном давлении;
в) бесконечно малом изменении давления.
34. Уравнение Клапейрона-Клаузиуса  определяет изменение температуры фазового перехода при:
определяет изменение температуры фазового перехода при:
а) любом изменении давления;
б) неизмененном давлении;
в) бесконечно малом изменении давления.
35. Метастабильное состояние – это состояние неустойчивого равновесия физической макроскопической системы (фазы). Не переходя в более устойчивое (при данных условиях) состояние (фазу), в таком состоянии система:
а) может находиться в течение малого промежутка времени;
б) может находиться длительное время;
в) не может находится длительное время.
36. Критическая точка – точка на диаграмме состояния, соответствующая критическому состоянию вещества. Состояние вещества в критической точке характеризуется критическими значениями:
а) температуры Tk, давления pk и объема Vk;
б) температуры Tk и давления pk;
в) температуры Tk и объема Vk;
г) давления pk и объема Vk.
37. Критическая точка в случае двухфазного равновесия – это точка окончания:
а) кривой равновесия фаз;
б) поверхности равновесия фаз;
в) кривой или поверхности равновесия фаз.
38. Фазовый переход первого рода характеризуется тем, что при его осуществлении:
а) поглощается или выделяется определенное количество теплоты, которое называют теплотой фазового перехода;
б) поглощается определенное количество теплоты, которое называют теплотой фазового перехода;
в) выделяется определенное количество теплоты, которое называют теплотой фазового перехода.
39. Фазовый переход первого рода характеризуется тем, что при его осуществлении значение таких термодинамических величин вещества, как плотность, концентрация компонентов, изменяется:
а) непрерывно;
б) скачком;
в) непрерывно и скачком.
40. Фазовый переход второго рода – это такой переход, при котором некоторая физическая величина, равная нулю с одной стороны от точки перехода, постепенно при удалении от точки перехода в другую сторону:
а) растет;
б) убывает;
в) не изменяется.
41. Фазовый переход второго рода – это такой переход, при котором плотность вещества:
а) не изменяется;
б) изменяется скачком;
в) изменяется непрерывно.
42. Фазовый переход второго рода – это такой переход, при котором:
а) не происходит выделения тепла;
б) не происходит поглощения тепла;
в) не происходит поглощения или выделения тепла.