Целлюлоза
Целлюлоза да крахмал сияқты табиғи полимер — полисахарид. Оның молекулалық формуласы да крахмалдікі сияқты (С6Н10О6)n.
Целлюлозаны клетчатка деп те айтады. Ол — өсімдіктер клеткасы кабықшасының негізгі кұрам бөлігі. Едәуір көп таралған биополимер. Мақта талшығында 98%-ке дейін, ағаш сүрегінде 50%-ке жуық, жасыл жапырақтарда, шөпте (10—25%) болады.
Целлюлозаның макромолекуласы циклді (3- глюкозаның қалдықтарынан тұрады, түзу құрылымды (46-сурет). Целлюлозаның макромолекулалары бір бағытта орналасқандықтан, талшық түзеді (зығыр, мақта, кендір, т.б.).

Целлюлозаның қарапайым буыны крахмалдікі сияқты — С6Н10О5 — бірақ в-глюкозаның қалдығынан құралған:

Крахмал мен целлюлозаның құрамына әр түрлі формалы глюкозаның кіруі олардың қасиеттеріне әсер етеді. Целлюлозаны тек қана күйіс қайыратын жануарлар қорыта алады. Адам және басқа жануарлар ферменттері целлюлозаны қорыта алмайды, сондықтан оны азық ретінде пайдаланбайды.
Целлюлозаның полимерлену дәрежесі — n-нің мәні крахмалдан көп, молекулалық массасы да крахмалдан үлкен (шамамен мақтада ~ 1,7 млн., зығырда ~ 6 млн-ға дейін) болады. Целлюлоза құрылымы тек түзу сызықты болады:
— С6Н10О5 — С6Н10О5 — С6Н10О5 — С6Н10О5 —
Мақта, зығыр, кендір, т.б. талшықты материалдардың целлюлозадан түзілетіндігі осыған байланысты.
Целлюлозаның қасиеттері
Целлюлоза ақ немесе сүр түсті талшықты қатты зат. Целлюлоза суда, спиртте, эфирде, ацетонда және т.б. органикалық еріткіштерде ерімейді.
Целлюлозаның гидроксил топтары арқылы әр түрлі эфирлерін алуға болады. Целлюлозаның құрамындағы глюкозаның әр қалдығында үш гидроксил тобынан болады:

Реакцияға бір, екі, үш гидроксил топтары қатысуы мүмкін. Реакцияны жүргізу жағдайына байланысты целлюлозаның әр түрлі нитраттары алынады:

Целлюлозаның нитраттары өте жанғыш және қопарылғыш заттар. Целлюлозадан толық емес нитрлеп, нитросырлар және лак алады. Толық нитрлеп, қопарылғыш зат (түтінсіз дәрі) өндіріледі.
Целлюлозаға сірке кышқылымен (немесе сірке ангидридімен) күкірт қышқылы қатысында әсер етіп, целлюлозаның диацетатын немесе триацетатын алуға болады:

Ацетатты талшық 
Целлюлоза суда ерімейді, бірақ суды бойына сіңіріп ісінеді. Сондықтан целлюлозаның туындыларын еритін қосылыстарға айналдырады. Мысалы, құрамында екі немесе үш ацетат тобы бар целлюлоза ацетонда ериді, бұл полимердің ерекше маңызы бар. Целлюлоза ацетатын ацетонда ерітіп, кішкентай тесіктер арқылы (фильер деп аталатын) өткізіп, жылы ауамен үрлеп кептіргенде, жіңішке жылтыр жіпке айналады (47-сурет). Бұл жіп ацетатты жібек талшығы деп аталады.
Целлюлозадан жасанды талшықтар алудың басқа да жолдары бар. Оның мыс тұздарының аммиактағы ерітіндісін мысты-аммиакты жібек деп атайды. Егер сілтілік ортада күкірткөміртекпен целлюлозаға әсер етсе, целлюлоза ксантогенаты түзіледі. Бұл тұз суда ерігіш. Бұдан жасалған жіп вискоза жібі деп аталады. Осы тәсілдер бойынша алынған жібек макромолекулаларының химиялық құрамы целлюлозаның құрамымен бірдей. Целлюлозадан өндірілетін талшық мақта талшығынан кейінгі екінші орынды алады.
Крахмал мен целлюлозаның айырмашылығы
Полисахаридтерге крахмал мен целлюлоза жатады. Олардың молекулалық формулалары — (С6Н10О5)n. Бұл полисахаридтердің бір-бірінен айырмашылығы:
· а) крахмал молекуласы α-глюкоза, ал целлюлоза молекуласы β-глюкоза қалдығынан тұрады;
· ә) құрамындағы буындар саны да (n) әр түрлі, крахмалда бірнеше мыңнан, целлюлозада бірнеше миллионға дейін жетеді;
· б) крахмал молекуласы құрылымы — түзу сызықты және тармақты, ал целлюлоза молекуласы — тек түзу сызықты. Сондықтан олардың қасиеттері өзгеше. Крахмалдың қоректік зат ретінде алатын орны ерекше. Крахмалды адам мен барлық жануарлар азық ретінде қабылдап, қорыта алады, ал целлюлозаны тек күйіс қайыратын малдар, ұлулар және микроорганизмдер ғана қорытады. Фотосинтез процесі нәтижесінде жұтылған күн энергиясы көмірсуларда қор болып жинақталады. Тыныс алғанда жұтылған оттекпен тотығып, көмірсулар жинақталған энергияны организмге береді. Табиғатта кең таралуына байланысты көмірсулар маңызды өнеркәсіптік шикізат болып табылады. Көмірсулардан этил спиртін, қопарылғыш заттар, дәрі-дәрмектер, қағаз, жасанды талшықтар өндіреді.[2]
· Крахмал (нем. kraftmehl) – өсімдіктерде болатын полимерлік көмірсу: (С6H10O5)n.
·
· Крахмал— өсімдіктердің басты қосалқы көмір суы; глюкоза қалдықтарынан түзілетін екі полисахаридтен (амилоза мен амилопектин) тұрады. Үн тәрізді ақ ұнтақ; көптеген өсімдіктерден алынады. Кулинария мен кондитер фабрикаларында көбінесе картоп, бидай және жүгерікрахмалын пайдаланады. Кисель, жеміс ботқаларын қоюлатуға, сондай-ақ кондитер бұйымдарына қосылады. Картоп крахмалы. Картопөндіріске гидравликалық транспортермен жуылып, жеңіл, ауыр қоспалардан ажыратылып, жуу машинасына түседі. Жуылған және өлшенген картоп ұнтақтау машинасында крахмалы босатылады. Келесі операция — осы ботқа сияқты қоймалжыңды ішіндегі клеткалық шырыннан бөлу. Ол үшін ботқаны крахмал сүтімен араластырып, ор түрлі електі аппараттарға береді. Електе ботқадан бос крахмал бөліп алынады және пайда болған крахмал сүті майда екінділерден тазаланады. Қалған өнім қайтадан ұнтақталады. Крахмал сүті езінді массасының көбінен ажырағанымен, құрамында әлі де езінді бар болғандықтан әрі қарай жібектен жасалған тор көздерден өткізіліп рафинацияламады. Рафинациялаған шырында езінді аз мөлшерде болғанды тан, одан тазалау үшін қайтадан сумен жуатын гидроциклондар мен тұндырмалы-жуу центрифугалары қолданылады. Осыдан алынған шикі крахмал кептіруге жіберіледі. Кептірілген крахмал арнаулы қаптарда сақталады. Тамаққа пайдаланылатын крахмалдың бөгде иісі, дәмі және ауыр қоспалары болмауы керек; төмен сортты крахмал техникалық мақсатқа жұмсалады немесе сірне өндіріледі.[1][2]
Целлюлоза (лат. cellula — клетка), полиглюкопираноза, (C6H10O5)n — негізгі құрам бөліктері өсімдіктер клеткаларының қабығын түзетін үлкен молекулалы көмірсу (полисахарид). Целлюлоза өсімдік тіндеріне мех. беріктік, серпімділік қасиет береді. Ол өсімдіктердеқарапайым көмірсулардан күрделі биохим. синтез нәтижесінде түзіледі. Целлюлоза макромолекуласының қарапайым бунақтары C6H10O5 — глюкоза ангидриді (глюкопираноза) болып саналады. Целлюлоза негізінен кейбір өсімдіктер талшықтарының құрамында болады, мыс., мақта талшығында (97 — 98%), ағашта (40 — 50%), тінді дақыл талшықтарында (зығырда және талшықты көп жылдық өсімдік — қытай қалақайында 80 — 90%), бір жылдық өсімдік сабақтарында (қамыс, жүгері, астық тұқымдастарда 30 — 40%), т.б. көп. Целлюлозаның молек. массасы қай өсімдіктен алынғанына байланысты бірнеше миллиондаған көміртектік бірлікке дейін барады. Оның молекуласының құрылымы сызықты тармақталған, сондықтан мақта, зығыр, кендір, т.б. талшықты материалдардың Целлюлозадан түзілетіндігі осыған байланысты.
Табиғи талшықтарда Целлюлоза макромолекулалары бір бағытта түзу орналасқандықтан талшықтары мех. берік болады. Тоқу кезіндемақта, зығыр талшықтарынан ұзын және берік жіптер ширатылады. Ағаштан алынған Целлюлоза молекулалары да сызықты тармақталғанымен ретсіз орналасып, бірыңғай бағытталмайды, сондықтан ағаштан жіп ширатылмайды. Табиғи және синтездік үлкен молекулалы қосылыстар сияқты Целлюлоза да жартылай дисперсті. Оның себебі — кіші молекулалы фракциялардың болуы. Целлюлозаны хим. жолмен қайта өңдеу одан жасалатын бұйымдардың қасиеттеріне күшті әсер етеді. Целлюлоза молекулалары күшті созылған, бірақ мықты емес, молекуласының пішіні әр түрлі әдістермен өңдеу кезінде көп өзгереді. Целлюлоза суда, сілті ерітіндісінде ерімейді, суда ісінеді, сілтілік металдар гидрототығының ерітінділерінде және кейбір тұздар мен қышқылдар ерітінділерінде күштірек ісінеді. Ағашты ауа қатыстырмай қыздырғанда Целлюлоза терм. жолмен ыдырап, органик. ұшқыш заттар және су, көмір түзеді. Түзілген органик. өнімдерде метил спирті, сірке қышқылы, ацетон болады. Табиғатта таза күйінде Целлюлоза кездеспейді. Целлюлоза азот қышқылы эфирлерінің маңызы зор, ол күкірт қышқылы қатысында Целлюлозаға азот қышқылымен әсер еткенде түзіледі. Целлюлоза мех. беріктігіне байланысты кеңінен қолданылады, одан түрлі бұйымдар дайындалады, мата тоқылады,арқан есіледі, қағаз жасалады. Целлюлозаны гидролиздеу және одан түзілген глюкозаны ашыту арқылы этил спирті алынады. Оның хим. өңдеу жолымен алынған эфирлері жасанды талшық, жұқа пленка, сыр, пластмасса, мылтық дәрісін өндіруде қолданылады.[1][2]
Сұйықтық газ бөлу бетіндегі адсорбция.Гиббс теңдеуі.
Сұйықтық-газ жанасу бетіндегі адсорбция шамасы Гиббс теңдеуімен сипатталады:
 (1),
(1),
мұнда:
Г – адсорбция шамасы, моль/м2;
dσ – dС концентрация өзгерісіне сәйкес беттік керілу өзгерісі Дж/м2;
Сор – концентрациялар аралығындағы ерітінді концентрациясының орташа мәні, моль/л;
Т – абсолюттік температура;
R – газ тұрақтысы, 8,3143 Дж град-1 моль-1
Беттік керілу ( 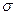 )күші деп фаза аралық шекарасында біріншіден сұйықтың бетінің тартылуын күшейтетін күшті айтады (Дж/м2 немесе Н/м).
)күші деп фаза аралық шекарасында біріншіден сұйықтың бетінің тартылуын күшейтетін күшті айтады (Дж/м2 немесе Н/м). 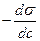 - беттік активтілік деп аталады.
- беттік активтілік деп аталады.
1) кері адсорбция : егер С өскенде, 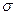 өссе, яғни
өссе, яғни  , онда (
, онда (  )
)
 ,
, 
2) оң адсорбция : егер С өскенде, 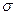 кемісе;
кемісе; 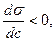 яғни (
яғни ( 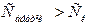 )
)
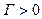 ,
, 
3)  , яғни (
, яғни ( 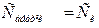 ) адсорбция болмайды ;
) адсорбция болмайды ; 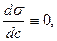
Г = 0 , 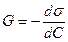
Қатты дене-газ бетіндегі адсорбция мөлшері Лэнгмюр теңдеуімен сипатталады:
 (2)
(2)
мұнда:
Г – адсорбция шамасы, моль/г;
Гmax – адсорбцияның максимал шамасы;
С – газдың тепе-теңдік концентрациясы;
А – десорбция және адсорбция жылдамдықтары константаларының қатынасы тең тұрақты шама. 






 Г
Г
 |
Қатты дене-сұйық бетіндегі молекулалық адсорбция мөлшері Фрейндлих теңдеуімен сипатталады:
 (3)
(3)
мұнда:
х – адсорбцияланған зат мөлшері, моль;
m – адсорбент өлшендісі, г;
С – тепе-теңдік концентрациясы, моль/л;
К и 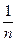 – эмпирикалық константалар.
– эмпирикалық константалар.
Осы теңдеуді логарифмдегенде, ол мынандай түрге ие болады:
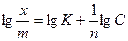 (4)
(4)
 |

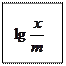




 |  |  |  | ||||

 0 C 0 Ig C
0 C 0 Ig C
Электролиттер адсорбциясы эквиваленттік, алмасу және таңдамалы адсорбция болып бөлінеді.Алмасу адсорбциясы адсорбент пен ерітінді арасында иондардың алмасуына негізделген. Катиондарды алмасуға қабілетті адсорбенттер катиониттер деп аталады.Аниондарды алмасуға қабілетті адсорбенттер аниониттер деп аталады.
Мысалы:
RH+ + K ↔ RK+ + H+ - катиондық алмасу,
катионит
ROH- + Cl- ↔ RCl- + OH- - аниондық алмасу,
анионит
мұнда:
R – поливалентті анион (-SO3H, -COOH, -PO3H) немесе катион (-NH3OH, = NH2OH, ≡ NOH).
Адсорбцияның медициналық-биологиялық маңызы зор. Ақуыздардың, холе қышқылдарының, фосфолипидтердің беттік активтілік қабілеті болады. Молекулалардың жасуша аралық кеңістіктен жасушаға немесе керісінше бастапқысына тасымалданғанында олардың жасушалық мембрана бетінде адсорбциялануы жүреді. Асқазанда тамақтың қорытылуы ферменттер әсерінен тек қана адсорбциялық қабатта жүреді: адсорбцияланған фермент → фермент-субстрат ФС аралық комплекс → ас қорыту.
Жұмысқа айналатын жылу мөлшері еркін энергия (G) - Гиббс энергиясы немесе изобаралық-изотермиялық потенциал (Т = const, р = const) деп аталады.
G = Н – Т S
DG = DН – ТDS (4)
Жүйенің тұрақтылығы Гиббс энергиясымен анықталады, оның таңбасы реакцияның бағытын көрсетеді:
DG < 0, өздігінен жүретін процестер
DG > 0, өздігінен жүрмейтін процестер
DG = 0, динамикалық тепе-теңдік.
1) егер DН < 0, DS > 0 болса, (4) теңдеу бойынша DG < 0 болады, яғни процесс өздігінен жүреді;
Н мен S өзгерістерінің басқа жағдайларында процестің жүру мүмкіндігі энтропиялық фактормен немесе энтальпиялық фактормен анықталады:
2) егер DН < 0, DS < 0 болса, реакцияның жүруі (DG < 0) энтальпиялық фактормен анықталады. Егер олардың абсолюттік мәндері келесідей |DН| > |ТDS| болса, реакция өздігінен жүреді;
3) егер DН > 0, DS > 0 болса, реакцияның жүруі (DG < 0) энтропиялық фактормен анықталады. Егер олардың абсолюттік мәндері келесідей |DН| < |ТDS| болса, реакция өздігінен жүреді.
Реакция бағытына температураның әсері:
1) DН<0, DS>0 болғанда, DG<0 қайтымсыз процесс, яғни ол температураға тәуелді емес.
2) Температураның DG-ға әсері DS-тың DG = DН – ТDS теңдеуден таңбасы мен шамасымен анықталады:
а) DS > 0 болғанда, температураның жоғарылауы –DG артуына әкеледі. б) DS < 0 болғанда, температураның жоғарылауы –DG кемуіне әкеледі, сондықтан DG > 0, онда реакция кері бағытта жүреді.
в) DS = 0 болғанда, DG ≠ f (Т).
Термодинамика функцияларының өзгерісін Гесс заңына сүйеніп, төмендегі формулалар бойынша есептейді:
DH0 = SDH0түз.(өнім) - SDH0түз.(баст. заттар)
DS0 = SDS0түз.(өнім) - SDS0түз.(баст. заттар)
DG0 = SDG0түз.(өнім) - SDG0түз.(баст. заттар)
DH0 ,DS0, DG0 мәндері анықтама кестелерінде беріледі.
Термодинамиканың бірінші бастамасы,анықтамасы, математикалық өрнегі
Жүйе мен қоршаған орта арасында энергия алмасудың екі түрлі формасы белгілі: жылу (Q) және жұмыс (A). Жылу және жұмыс бір күйден екінші күйге ауысу тәсіліне байланысты энергия берудің біркелкі емес формасы болып табылады. Жұмыс – энергия берудің ретті формасы. Бір дене бағытталған күшті дамытады да соның нәтижесінде басқа денеге жұмыс жүргізіледі. Мысалы, газдың ұлғаю жұмысы A = P·DV. Жылу(Q) – энергия берудің ретсіз формасы. Ол тек бір дене молекулаларының басқа дене молекулаларымен түйіскенде ғана беріледі. Жылу және де жұмыстың өлшем бірлігі СИ жүйесі бойынша джоуль (Дж).
Химиялық реакция жүргенде жүйелердің ішкі энергиялары өзгереді, яғни жылу бөлінеді (экзотермиялық реакциялар) немесе сіңіріледі (эндотермиялық реакциялар).
Ішкі энергияның өзгерісі:
∆U = Q - A (1)
мұнда:
Q – химиялық реакцияның жылу эффектісі;
A – жұмыс.
Көлем тұрақты болғанда (изохоралық процесс) ∆U = Qv (2), себебі жұмыс нөлге тең.
Қысым тұрақты болғанда, энтальпияны қолдану ыңғайлы. Ол ішкі энергиямен байланысты.
H = U + PV (3)
Тұрақты қысымда:
Qp = ∆H (4)
Тұрақты қысымда реакцияның жылу эффектісі энтальпия өзгерісіне тең.
Термодинамика екі заңға, яғни термодинамиканың бірінші және екінші бастамаларына негізделген.
Энергияның әр түрі бір-біріне қатаң эквивалентті мөлшерде ауысады. Ю. Майер (1842 ж) и Д. Джоуль (1843 ж), Гельмгольц (1847 ж) энергия сақталу заңын тұжырымдады. Р.Клаузиус оны термодинамиканың I бастамасы деп атады. Бұл заңның бірнеше анықтамасы бар:
Тұйық жүйеде энергияның барлық түрлерінің қосындысы тұрақты.
Энергия жоқтан пайда болмайды және де жойылмайды, ол энергияның бір түрінен басқа түріне эквивалентті мөлшерде ауысады.
Бірінші текті мәңгі қозғалтқыш мүмкін емес (сырттан жылу бермей-ақ жұмысты орындай алатындай машинаны жасап шығаруға болмайды)
Термодинамиканың бірінші заңы бойынша энергияның барлық түрлері бір-біріне қатаң эквивалентті мөлшерде ауысады. Егер жүйе сыртқы ортадан жылуды сіңірсе, онда ол ішкі энергияның өзгерісіне және жұмысты орындауға жұмсалады. Заңның математикалық өрнегі былай жазылады:
Q = DU + A
мұнда, DU – жүйенің ішкі энергияның өзгеруі, кДж;
Q – жылу; A – жұмыс.
Жүйеге берілген жылу Q оның ішкі энергиясының DU өзгерісіне және жүйенің сыртқы денелермен істейтін А жұмысына жұмсалады.
Химиялық практикада көбінесе қысым тұрақты (Р = const) болғанда жүретін (изобаралық) процестерді пайдаланады. Термодинамиканың бірінші бастамасын математикалық тұрғыдан түсіну үшін 6.1 суретке назар аударайық.

Термодинамикалық жүйе ретінде цилиндрдің поршені (1) астында орналасқан газды (2) аламыз. Жылжымалы поршень цилиндр қабырғасын бойлай үйкеліссіз орын ауыстырады. Бастапқы күйде газдың температурасы қоршаған ортаның температурасына тең. Поршеньге түсетін ішкі және сыртқы қысым (Р) бірдей болғандықтан, поршень тыныштықта тұрады. Газға біраз жылу мөлшерін берейік. Газ ұлғая бастайды және поршень Dh қашықтыққа жоғары көтеріледі. Газдың бастапқы және соңғы көлемдерін V1 және V2 деп белгілейік. Сонда поршень ауданының, оның орын ауыстыруына көбейтіндісі газ көлемінің өзгеруіне тең:
SDh = V2 –V1 = DV
жүйенің көлемін DV ұлғайтқанда, ол рDV тең жұмысты орындайды. Изобаралық ұлғаю кезінде (Р = const) газдың сыртқы күштерге қарсы атқарған жұмысы газ қысымын оның соңғы және бастапқы көлемдерінің айырымына көбейткенге тең.
А = р(V2 –V1) = рDV
Термодинамиканың бірінші заңы изобаралық процестер үшін мына формуламен өрнектеледі:
Q = D U + А = D U + р DV = U2 –U1 + р(V2 –V1)
Бұл жағдайда процесс энтальпиямен (Н) сипатталады, оның өзгерісі мына теңдеумен анықталады:
DН = DU + р DV,
мұнда, DН - энтальпияның өзгерісі, DU – ішкі энергияның өзгерісі, р – қысым, DV – көлемнің өзгерісі.
Изобаралық процесте энтальпияның өзгеруі кері таңбамен алынған жылу эффектісіне тең:
DН = -Qр
Энтальпия жүйенің жылу қоры болып табылады.
Физикалық химия пәні мен міндеттері. Физикалық химияның бөлімдері.Физикалық химияның медицина мен ветеринариядағы маңызы.
Физикалық химия химиялық құбылыстарды физикалық принциптері мен заңдары негізінде түсіндіретін ғылым. Физикалық химия пәні химиялық реакцияларды және онымен қоса жүретін физикалық құбылыстарды қарастырады. Ол заттың құрылысы, химиялық термодинамика, химиялық кинетика, фотохимия, ерітінділер, электрохимия, беттік құбылыстар, коллоидтық химия сияқты бөлімдерден тұрады. Физикалық химияның даму барысында М.В.Ломоносов, Г.И.Гесс, Н.Н.Бекетов, А.М.Бутлеров, Д.И.Менделеев, В.Оствальд, В.Гофф, М.И.Усанович сияқты және басқа да ғалымдардың қосқан үлесі зор.
Физикалық химия заттың құрылысын, химиялық процестердің жүйедегі тепе-теңдік жағдайы мен оның бір күйден екінші күйге ауысу мүмкіндігін, химиялық реакция жылдамдығының уақытқа байланысты ( 

 ) өзгеруін, электрлік және химиялық энергиялардың өзара ауысу заңдылықтарын зерттейді. Химиялық реакциялар электрлік құбылыстар, жылу алмасу, электромагниттік жиіліктердің жұтылуы немесе сәулелененуі сияқты физикалық процестермен тығыз байланысты. Физикалық химияның ауыл шаруашылығында маңызы өте зор. Мысалы, химиялық термодинамика мен химиялық кинетиканың заңдарын білу қалыпты және патологиялық тірі ағзаларда жүретін биохимиялық процестерді түсінуге мүмкіндік береді; тірі ағзалардағы процестер тек сулы ерітінділерде жүреді, ерітінділердің қасиеттерін білу осмостық гомеостаздың механизмдерін (ағзаның ішкі ортасының динамикалық тепе-теңдігі өзгерісіне қарсы әсер ететін ағзаның бейімделген реакциялар жиынтығы), протолиттік гомеостаз және оны бұзу процестерін түсінуге мүмкіндік береді; адсорбциялық құбылыстардың теориясы қалыпты және патологиялық ішкі жасушалық мембраналарда жүретін беттік құбылыстардың мәнін түсінуге мүмкіндік береді; ағзаның барлық сұйықтықтары – қан, лимфа, жасуша сөлі коллоидтар болып келеді. Оларда жүретін процестер коллоидтық химияның қағидаларымен түсіндіріледі.
) өзгеруін, электрлік және химиялық энергиялардың өзара ауысу заңдылықтарын зерттейді. Химиялық реакциялар электрлік құбылыстар, жылу алмасу, электромагниттік жиіліктердің жұтылуы немесе сәулелененуі сияқты физикалық процестермен тығыз байланысты. Физикалық химияның ауыл шаруашылығында маңызы өте зор. Мысалы, химиялық термодинамика мен химиялық кинетиканың заңдарын білу қалыпты және патологиялық тірі ағзаларда жүретін биохимиялық процестерді түсінуге мүмкіндік береді; тірі ағзалардағы процестер тек сулы ерітінділерде жүреді, ерітінділердің қасиеттерін білу осмостық гомеостаздың механизмдерін (ағзаның ішкі ортасының динамикалық тепе-теңдігі өзгерісіне қарсы әсер ететін ағзаның бейімделген реакциялар жиынтығы), протолиттік гомеостаз және оны бұзу процестерін түсінуге мүмкіндік береді; адсорбциялық құбылыстардың теориясы қалыпты және патологиялық ішкі жасушалық мембраналарда жүретін беттік құбылыстардың мәнін түсінуге мүмкіндік береді; ағзаның барлық сұйықтықтары – қан, лимфа, жасуша сөлі коллоидтар болып келеді. Оларда жүретін процестер коллоидтық химияның қағидаларымен түсіндіріледі.
Химиялық реакцияның жылу эффектісі. Гесс заңы. Химиялық реакцияның жылу эффектісін есептеу.
Термохимияның негізгі заңы болып Гесс заңы табылады:
Гесс заңы бойынша химиялық реакцияның жылу эффектісі оның жүру жолына тәуелді емес, әрекеттессуші заттардың бастапқы және соңғы күйіне байланысты болады.
Мысалы, көміртек (IV) оксидін СО2 көміртекті толық тотықтыру арқылы тікелей алуға, ал сонымен қатар аралық саты – көміртек (II) оксидін СО алу арқылы да (2 сатымен) алуға болады. Осы үрдістің сатыларын және олардың жылу эффектілерін (энтальпияларын) қарастырайық:
бастапқы күйі соңғы күйі
I С(қ) + О2 (г) = СО2 (г) DH = - 393,5 кДж
II С(қ) + ½ О2(г) = СО(г) DH = -110,5 кДж
III СО(г) + ½ О2(г) = СО2(г) DH = -283,0 кДж
Екінші және үшінші реакциялардың сол және оң жақтарын қоссақ, бірінші реакцияны аламыз:
С(қ) + О2 (г) = СО2 (г)
Сонымен, олардың жылу эффектілерін де қосамыз: DH1 = DH2 + DH3 = -110,5 – 283,5 = - 393,5 кДж, сонда бірінші үрдістің жылу эффектісі аралық сатылардың жылу эффектілерінің қосындысына тең болады.
Химиялық реакцияның жылу эффектісін (энтальпия өзгерісін) бастапқы заттардың және өнімдердің түзілу немесе жану стандартты энтальпиялары негізінде Гесс заңының салдарларын пайдаланып, есептеп шығаруға болады:
1)Химиялық реакцияның жылу эффектісі стандартты жағдайларда реакция өнімдерінің түзілу энтальпияларының қосындысы мен бастапқы заттардың түзілу энтальпияларының қосындысының айырмасына тең:
DH0 = SDH0түз.(өнім) - SDH0 түз.(баст. заттар)
2)Химиялық реакцияның жылу эффектісі стандартты жағдайларда бастапқы заттардың жану энтальпияларының қосындысы мен реакция өнімдерінің жану энтальпияларының қосындысының айырмасы тең:
DH0 = SDH0жану(баст. заттар) - SDH0жану(өнім)
Екінші салдар биохимиялық реакциялардың жылу эффектілерін есептеу үшін жиі пайдаланылады. Гесс заңы негізінде тағамдардың және жемдердің құндылығын есептеп шығаруға болады. Бүкіл ағза үшін азық-түлік тағамдарындағы көмірсулардың тотығуы, ақуыздардың, майлардың ыдырауы энергия көзі болып табылады.
Химиялық термодинамика. Негізгі түсініктер: жүйе, және сыртқы орта; жүйенің термодинамикалық параметрлері;термодинамикалық процестер және олардың түрлері; күй функциясы
Энергияның бір түрден басқа түрге айналу заңдылықтарын зерттейтін ғылым термодинамика деп аталады. Термодинамиканың негіздерін білу ағзаның қоршаған ортамен алмасу процестерінің заңдылықтарын түсіндіруге мүмкіндік береді.
Химиялық термодинамика заттардың энергетикалық сипаттамаларын және химиялық процестер кезіндегі энергия өзгерістерін қарастыратын физикалық химияның тарауы. Химиялық термодинамикаэнергияның химиялық түрінің энергияның басқа түрлеріне ауысуын зерттейді, ол химияның теориялық негізі болып табылады.
Химиялық термодинамика:
- әр түрлі химиялық заттардың тепе-теңдікте болу жағдайларын;
- химиялық реакциялардың өздігімен жүру мүмкіндіктерін;
- химиялық реакция кезінде жылу және энергияның қарым-қатынастарын;
- химиялық тепе-теңдік және химиялық реакциялардың бағыты туралы принциптерді қарастырады.
Химиялық реакция – бір заттардың басқа заттарға айналуы жүретін процесс, яғни бастапқы заттардағы химиялық байланыстар үзіледі және реакция өнімдерінде жаңа химиялық байланыстар түзіледі. Химиялық реакция жүргенде жүйелердің ішкі энергиялары өзгеріске ұшырайды, яғни жылу бөлінеді (экзотермиялық реакциялар) немесе сіңіріледі (эндотермиялық реакциялар).
Термодинамикалық негізгі түсініктеріне:термодинамикалық жүйе, күй функциялары (ішкі энергия, энтальпия, энтропия, еркін энергия), жүйенің термодинамикалық параметрлері жатады.
Термодинамикалық жүйе деп қоршаған ортадан шын немесе ойша бөлінген дене немесе денелер жиынтығын айтады. Мысалы, биологиялық жүйелерге күрделену реті бойынша: органелла ® жасуша ® ұлпа (тін) ® орган (мүше) ® ағза ® популяция ® биоценоз ® биосфера жатады. Адам мен жануарлар ағзасының қоршаған ортадан бөліну беттері (термодинамикалық жүйе) болып тері жабындылары, өкпелер альвеолалары, нефрондар мембраналары болып табылады.
Жүйелер гомогенді және гетерогенді, ашық, жабық және оқшауланған болып келеді.
Гомогенді жүйе деп жанасу беттері жоқ біртекті жүйені атайды. Мысалы, сулы шынайы ерітінділер.
Гетерогенді жүйе деп жанасу беті арқылы бөлінген біртекті емес жүйені атайды. Мысалы, судағы мұз.
Гомогенді жүйе бір фазадан, ал гетерогенді жүйе бірнеше фазадан тұрады.
Қоршаған ортамен зат және энергия алмасу жүретін жүйені ашық жүйе деп атайды. Мысалы, адам, жануар және басқа тірі ағзалар ашық термодинамикалық жүйеге жатады. Дем алу, жылу алмасу, тамақтану арқылы сыртқы ортамен затпен де энергиямен де алмасады. Адам 40 жыл ішінде орташа есеппен 40 т сумен, 6 т тамақпен, шамамен 12 млн. л оттекпен қоректенеді.
Қоршаған ортамен энергия алмастыра алатын, бірақ зат алмастыра алмайтын жүйені жабық жүйе деп атайды. Мысалы: суыған тас.
Қоршаған ортамен зат (масса) және энергия (жылу, жұмыс) түрлерін алмастыра алмайтын жүйені оқшауланған жүйе деп атайды.

Термодинамикалық жүйенің күйі термодинамикалық параметрлермен (масса m, көлем V, энергия E, жылусыйымдылық G, температура Т, қысым Р, тығыздық r, концентрация және т.б.) сипатталады.
Параметрлер интенсивті жәнеэкстенсивтіболып екіге бөлінеді.
Шамасы жүйенің массасына тәуелсіз параметрлер интенсивті деп аталады. Оларға температура (Т), қысым (Р), тығыздық (r), тұтқырлық (ŋ), концентрация (С), химиялық потенциал (µ) жатады.
Экстенсивті- шамасы жүйенің массасына тәуелді параметрлер. Оларға көлем (V), масса (m), ішкі энергия (U), энтальпия (Н), энтропия (S), термодинамикалық потенциалдар жатады.
Егер жүйе бірнеше жүйелерден түзілетін болса, экстенсивті параметрлер шамасы қосылады, ал интенсивті параметрлер шамасы теңеседі. Мысалы Т1 және Т2 температуралардағы екі жүйе өзара әрекетескенде, олардың жалпы жүйесінің температурасы орташа мәнге ие болады.
Жүйенің әр күйіне параметрлердің белгілі жиынтығы жауапты. I күйге – P1,V1,T1; II күйге – P2,V2,T2 сәйкес. Бір күйден (I) екінші күйге (II) ауысқанда термодинамикалық параметрлерлердің жиынтығы өзгеріске ұшырайды, яғни термодинамикалық процесс жүреді.
Тұрақты көлемде жүретін процестер изохоралық (V = const), тұрақты қысымда жүретін процестер изобаралық (P = const), тұрақты температурада жүретін процестер изотермиялық (T = const) деп аталады).
Биохимиялық көзқараспен қарағанда тірі ағзаларда жүретін процестер катаболиттік(органикалық қосылыстардың суға, көмір қышқыл газына және мочевинаға ыдырауы мен тотығуы) және анаболиттік(органикалық қосылыстардың синтезі) болып бөлінеді.
Термодинамикалық жүйелер күй функцияларымен сипатталады: U – ішкі энергия, H – энтальпия, S – энтропия, G – еркін энергия (Гиббс энергиясы). Күй функциялары деп мәндері бір күйден екінші күйге ауысу жолына байланысты емес, тек жүйенің бастапқы және соңғы күйіне тәуелді функцияларды айтады.
Жүйе функцияларының (X) өзгерісін (ΔХ) деп белгілейді. ( Мысалы ΔH, ΔU т.б. ΔХ = Х2 - Х1, мұндағы Х1 - алғашқы мәні, Х2 - соңғы мәні). Тұйықталған процесте кез-келген жүйе функцияларының өзгерісі нөлге тең болады (ΔХ=0). Бірнеше өзгерістерден кейін жүйе бастапқы күйіне келетін термодинамикалық процесті тұйықнемесе циклді деп атайды.Күй функцияларының бірі ішкі энергия (U). Ішкі энергия деп жүйені құраушы бөлшектердің (молекулалар, атомдар, иондар, электрондар, протондар және т.с.с.) кинетикалық және потенциалдық энергияларынан тұратын жүйе энергиясының қорын айтады.
Термодинамиканың негіздерін «Термодинамиканың бастамалары» деп аталатын екі заң құрайды.
Энтропия. Термодинамиканың екінші бастамасы,анықтамасы,математикалық өрнегі.
Термодинамиканың екінші бастамасы энергияның беру бағытын көрсетеді. Бұл ауысу екі фактормен анықталады:
1) жүйенің ішкі энергиясын азайтуға тырысуы
2) жүйенің ең ықтимал күйге келуге тырысуы.
Энергияның беруі (ауысуы) энтальпияның өзгерісімен ∆Н сипатталады. Бөлшектердің реттілігін сипаттау үшін S–Энтропия шамасы енгізілген.Энтропия (S) жүйенің күй ықтималдығының (ретсіздік) өлшемі болып табылады. Энтропия жүйенің ретсіздікке талпынуын, тұрақсыздықтың азаюын сипаттайды. Мысалы, қыздыру, булану, балқу процестері кезінде молекулалардың ретсіздігі артады, яғни энтропия артады. Энтропияның өсуі көптеген айырылу реакциялары үшін, сондай-ақ қатты дене → сұйықтық, сұйықтық → газ фазалық ауысулары үшін тән. Керісінше, конденсация, қату, кристалдану, полимерлену процестері кезінде молекулалардың қозғалысы кемиді, яғни энтропия кемиді. Энтропияның кемуі көптеген қосылу реакциялары, сонымен қатар газ → сұйықтық, сұйықтық → қатты дене фазалық ауысулары жүргенде байқалады.
Энтропия және оның жүйе күйінің ықтималдығымен байланысын қарастырайық.
1) Энтропия ретсіздіктің сандық өлшемі екендігін келесі мысалдар арқылы көрсетуге болады:
3Н2 + N2 = 2NH3
Термодинамиканың екінші бастамасының анықтамалары:
Клаузис постулаты (1850 ж): жылудың суық денеден ыстық денеге өздігінен ауысуы мүмкін емес.
Томсон постулаты (1851 ж): процеске қатысатын денелердің ең салқыны жұмыс көзі бола алмайды.
Оқшауланған жүйеде өздігінен процестер жүргенде, жүйенің энергиясы жоғары деңгейден төменгі деңгейге ауысады.
Табиғатта жүретін барлық процестер өздігінен ықтималдығы төмен күйден ықтималдығы жоғары күйге ауысуға ұмтылады.
Мәнгі қозғалғыштың екінші түрін жасауға болмайды.
Изотермиялық қайтымды процестер үшін термодинамиканың екінші бастамасының математикалық өрнегі былай жазылады:
 =
=  немесе
немесе  =
= 
Энтропияның өлшем бірлігі Дж/моль∙К .
Күй функциясы ретінде энтропияның өзгерісін (Гесс заңының салдарларын пайдаланып) мына теңдеу бойынша есептеп шығаруға болады:
DS0 = SDS0түз.(өнім) - SDS0түз.(баст. заттар)
Термодинамиканың екінші бастамасы (энтропияның өсу заңы):
Әр түрлі энергиялардың жылуға толық айналуын, ал жүйеге келтірілген жылудың жұмысқа толық айналмауын көрсетеді.