Нефтяной газ и его свойства.
Газы нефтяных и газовых месторождений по химической природе сходны с нефтью. Газы нефтяных месторождений, добываемые вместе с нефтью, называют нефтяными газами, а газы газовых месторождений называются природными газами. Природные и нефтяные газы состоят из предельных углеводородов: метанаСН4, пропана С3Н10, пентана С5Н12 и так далее. Часто углеводородные газы в своем составе содержат сероводородН2S, азот N, двуокись углерода CO2, гелий He, аргон Ar, пары ртути Hg. Содержание сероводорода, азота, углекислого газа достигает нескольких десятков процентов, а остальных примесей- долей процента.
В нормальных условиях при атмосферном давлении и температуре 0о С углеводороды от метана (СН4) до бутана С4Н10)всегда находятся в газообразном состоянии.
Молекулярная масса М углеводородных газов определяется по формуле:
М= , (5)
, (5)
Где  - Молекулярная масса i-го компонента;
- Молекулярная масса i-го компонента;  -доля компонента в смеси по объему.
-доля компонента в смеси по объему.
Учитывая, что природный газ состоит из метана, молекулярная масса нефтяного газа больше.
Если при постоянной температуре повышать давление газа, то при достижении определенного давления этот газ перейдет в жидкую фазу. Для каждого газа существует своя предельная температура, выше которой этот газ нельзя перевести в жидкое состояние. Максимальная температура, при которой данный газ может перейти в жикое состояние при повышении давления, называется критической температурой. Для метана критическая температура -82,1 о С, для этана + з2,3о С, для азота -146,9оС. Давление, соответствующее критической температуре, называется критическим давлением. Температура, при которой вещество с повышением давления до определенной величины из газообразной фазы переходит в жидкую, называется точкой росы или точкой начала конденсации. Эта же температура при снижении давления является точкой испарения, т.к. при этом вещество из жидкой фазы начинает переходить в газообразную.
Пропан и бутан легко переходят в жидкость даже при небольших давлениях. Давление, необходимое для перевода того или иного углеводорода из газообразного состояния в жидкое, т.е. упругость его паров , повышается с ростом его температуры. При данной температуре оно тем больше, чем ниже плотность углеводорода. Наибольшей упругостью паров обладает метан, который при нормальных условиях невозможно перевести в жидкость, т.к. его критическая температура -82,1о С. Так же трудно переводится в жидкое состояние этан. В зависимости от преимущественного содержания в нефтяных газах легких или тяжелых углеводородов газы разделяются на сухие и жирные.
Сухой газ – это естественный газ, в котором не содержатся тяжелые углеводороды или содержатся в небольших количествах.
Жирный газ – это газ, в котором тяжелые углеводороды содержатся в таких количествах, когда можно получать сжиженные газы или газовые бензины. Сухим принято считать газ, в 1 м3 которого содержится меньше 60 г газового бензина, а жирным –если в1м3 содержится более 60 г газового бензина.
Жирные газы чаще содержатся в легких нефтях, а сухой газ- в тяжелых нефтях. Одним из основных физических параметров нефтяного газа является его плотность.
Плотностью называется отношение массы вещества к занимаемому объему:
P= , (6)
, (6)
Где m- масса вещества, кг; V –объем, м3; p-плотность, кг/м3.
Плотность газа можно определить взвешиванием или вычислить, когда знаем молекулярную массу смеси:
P= , (7)
, (7)
Где 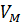 -объем моля газа при стандартных условиях, м3; 22,4 –газовая постоянная.
-объем моля газа при стандартных условиях, м3; 22,4 –газовая постоянная.
Плотность газа P находится в пределах 0,73-1 кг/м3..
На практике пользуются относительной плотностью газа, которая показывает, во сколько раз масса данного газа, заключенного в определенном объеме при данных давлениях и температуре, больше или меньше массы сухого воздуха, заключенного втом же объеме и при тех же условиях:
 , (8)
, (8)
Где 

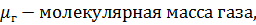

Относительные плотности некоторых углеводородови их примесей ( в нормальных условиях) составляют : водух-1; N2-0,9673; CO2 -1,5291; H2S-1,1906; CH4 -0,553; C2H6 -1,038;C3H8-1,523; C4H10-2,007.
В пласте углеводородные газы находятся в различных условиях. С увеличением давления от 0 до 3-4 МПа объем газов уменьшается.
С увеличением температуры при постоянном объеме газов сжимаемость газов уменьшается.
Приведенным давлением Рпр называется отношение давления газа к его критическому давлению Ркр:
Рпр= . (9)
. (9)
Давление, соответствующее точке критической температуры, называется критическим давлением.
Приведенной температурой газа Тпр называется отношение абсолютной температуры Т к его критической температуре:
Тпр= . (10)
. (10)
Критическая температура Ткр – это температура, при которой исчезает граница между жидкостью и паром. Для углеводородных газов, представляющих собой смесь отдельных компонентов, величины Ркр и Ткр определяются как среднеарифметические.
Если известен объем газа Vo при нормадьных условиях (Po и To ), то объем его при других давлениях и температурах( P и T) сучетом сжимаемости можно определить на основе закона состояния идеального газа:
V=V0Z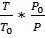 , (11)
, (11)
Где Т0=273оК.
Для перехода от объема, занимаемого газом в нормальных условиях, к объему газа в пластовых условиях пользуются объемным коэффициентом, который занял бы 1 м3 газа в пластовыхусловиях. Объемный коэффициент газа из формулы (11)
В=Z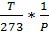 , (12)
, (12)