Основные сведения о строении твердых тел
Современная физика рассматривает атомы как частицы, состоящие из положительно заряженных ядер, окруженных электронными оболочками. Электроны относятся к категории микрочастиц, которым присущ принцип дуализма, то есть они обладают как свойствами частицы, так и свойствами волны. Ни видеть, ни осязать электроны нельзя. Поэтому, изучая их, приходится пользоваться моделями и абстракциями. Простейшей, наиболее наглядной моделью, является модель Н. Бора, в которой электроны уподобляются шарикам, вращающимся вокруг ядра по определенным орбитам. С точки зрения квантовой физики такое представление ошибочно, так как микрочастица не может одновременно обладать определенными значениями координаты и импульса. Поэтому применительно к микрочастице понятие траектории теряет смысл. Квантовая механика в состоянии предсказать лишь вероятность нахождения электрона в данной точке пространства. Эта вероятность представляет собой «усредненную» картину поведения электрона, что позволяет представить электрон в виде облака, которое называют орбиталью.
Если в атоме водорода, удаляясь от ядра, проследить вероятность нахождения электрона, то окажется, что у самого ядра она равна нулю, потом возрастает, достигая максимального значения на расстоянии 0,53×10-8 см от ядра, а затем постепенно убывает. Расстояние r=0,53×10-8 см условно принимают за радиус орбиты в атоме водорода, а сам электрон рассматривают в виде шарика с массой m=9,1×10-31 кг и зарядом q=1,6×10-19 Кл. Количество вращающихся вокруг ядра электронов определяется порядковым номером химического элемента в периодической системе Д. И. Менделеева: в атоме водорода — один электрон, в атоме гелия — два и т. д.
Движение электронов вокруг ядра происходит по строго определенным орбитам так, что на длине орбиты укладывается целое число длин волн, называемых волнами Де Бройля. При этом условии на длине орбиты образуется стоячая волна и не происходит излучения электромагнитной энергии. В противном случае электрон будет терять свою энергию, радиус орбиты станет уменьшаться и в результате электрон окажется притянутым к ядру.
Вращение электронов в атомах происходит как по круговым, так и эллиптическим орбитам. Движение электрона по круговой орбите соответствует сферическому электронному облаку, а движение по эллиптической орбите — облаку в форме гантели. При этом электроны стремятся занять наиболее низкие энергетические уровни, но при условии, что на каждом энергетическом уровне находится не более двух электронов (принцип Паули). Чем больше электронов в атоме, тем более высокие энергетические уровни они занимают. Возможные энергетические состояния электронов характеризуют четырьмя квантовыми числами.
Главное квантовое число может принимать значение n=1, 2, 3 и т. д. Состояния электрона, определяемые главным квантовым числом, называют энергетическими уровнями.
Орбитальное квантовое число l может принимать значения l=0, 1, 2,..., (n–1). Энергетические состояния, характеризующиеся различными значениями l, называют подуровнями. Значению l=0 соответствует s-подуровень, значению l=1 — p-подуровень, значению l=2 — d-подуровень, значению l=3 — f-подуровень.
Магнитное квантовое число m определяет пространственную ориентацию эллиптической орбиты. Оно может принимать значения m=0, ±1, ±2, ..., ±l. Каждому квантовому числу l соответствует (2l+1) по-разному ориентированных орбит. При l=1 возможны три взаимно-перпендикулярных р-орбиты; орбитальному квантовому числу l=2 соответствует пять возможных пространственных ориентаций орбит, называемых d-орбитами; квантовому числу l=3 соответствует семь f-орбит.
по-разному ориентированных орбит. При l=1 возможны три взаимно-перпендикулярных р-орбиты; орбитальному квантовому числу l=2 соответствует пять возможных пространственных ориентаций орбит, называемых d-орбитами; квантовому числу l=3 соответствует семь f-орбит.
Спиновое квантовое число s определяет направление вращения электрона вокруг ядра. Оно может принимать значения +0,5 или –0,5.
Определим число возможных энергетических состояний на любом из энергетических уровней. На первом энергетическом уровне (n=1) могут разместиться два электрона с противоположными спинами, что можно записать в виде: 1s2, где 1 — номер энергетического уровня, s — состояние электрона на этом уровне, 2 — количество электронов в данном состоянии. На втором энергетическом уровне (n=2) в s-состоянии могут находиться два электрона (2s2), в p-состоянии — шесть электронов (2p6). На третьем энергетическом уровне (n=3) в s-состоянии могут находиться два электрона (3s2), в p-состоянии — шесть электронов (3p6), в d-состоянии — десять электронов (3d10) и т. д.
Проследим, как заполняются электронные оболочки атомов по мере роста порядкового номера химического элемента в периодической таблице Д. И. Менделеева. В атоме водорода имеется один электрон на орбите 1s с произвольной ориентацией спина. Его энергетическое состояние может быть записано так: 1s1. В атоме гелия имеется два электрона с противоположными спинами. Его энергетическое состояние может быть записано так: 1s2. В атоме лития первая оболочка полностью заполнена электронами, поэтому третий электрон располагается на уровне 2s, в результате получается электронная конфигурация 1s22s1. У бериллия структура оболочки имеет вид 1s22s2. У бора пятый электрон занимает состояние 2p и структура принимает вид 1s22s22p1. У последующих элементов происходит дальнейшее заполнение состояния 2p. У неона все возможные состояния 2p полностью заняты, и структура принимает вид 1s22s22p6. Аналогичным образом происходит заполнение электронных оболочек третьего и последующих периодов периодической таблицы.
Атомы элементов каждой группы периодической таблицы имеют одинаковое строение внешних и достраивающихся оболочек. Это наглядно видно на примере элементов четвертой группы:
l углерод (C) — 1s22s22p2;
l кремний (Si) — 1s22s22p63s23p2;
l германий (Ge) — 1s22s22p63s23p63d104s24p2.
Периодическая повторяемость структуры внешних электронных оболочек обусловливает периодическую повторяемость химических свойств элементов. Так, например, кремний и германий качественно обладают одинаковыми свойствами, различие состоит лишь в количественной оценке этих свойств.
Молекулы и твердые тела образуются в результате химических связей, осуществляемых посредствам валентных электронов, находящихся на внешних, не полностью занятых электронных оболочках. При этом происходит обобществление валентных электронов и уже нельзя говорить о принадлежности электрона к одному из атомов. Например, атомы углерода, кремния и германия, которые входят в четвертую группу периодической системы элементов и имеют валентность, равную четырем, в твердом теле образуют структуру, в которой каждый атом связан с четырьмя ближайшими своими соседями и оказывается окруженным восьмью обобществленными электронами. Такая связь характеризуется очень высокой прочностью.
В твердом теле атомы расположены настолько близко друг к другу, что каждый атом оказывается в поле своих соседей, с которыми он взаимодействует. Вследствие этого каждый энергетический уровень расщепляется на большое число близко расположенных подуровней, образующих энергетическую зону. Расстояние между подуровнями очень мало. В кристалле размером 1 см3 содержится 1022 атомов. При ширине зоны порядка 1 эВ расстояние между подуровнями в ней равно 10-22 эВ. Это расстояние столь ничтожно, что зоны можно считать непрерывными.
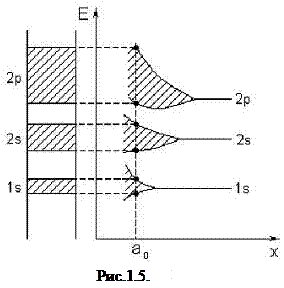 Механизм образования энергетических зон схематически показан на рис. 1.1. По мере сближения атомов (уменьшения расстояния между ними) сначала расщепляются самые высокие энергетические уровни, затем более низкие. При сближении атомов на расстояние а0 образуется устойчивая кристаллическая структура, которой соответствует энергетическая диаграмма, показанная в левой части рисунка. Каждому энергетическому уровню изолированного атома соответствует зона разрешенных энергий: уровню 1s- зона 1s, уровню 2s- зона 2s и т.д. Зоны разрешенных энергий разделены областями запрещенных энергий – запрещенными зонами. С увеличением энергии электрона в атоме ширина разрешенных зон возрастает, а ширина запрещенных зон соответственно уменьшается. Электроны в атоме занимают наиболее низкие энергетические уровни, поэтому соответствующие им зоны также оказываются заполненными. Самую верхнюю из зон, частично или полностью заполненную электронами, называют валентной зоной, а расположенную выше неё свободную от электронов зону называют зоной проводимости
Механизм образования энергетических зон схематически показан на рис. 1.1. По мере сближения атомов (уменьшения расстояния между ними) сначала расщепляются самые высокие энергетические уровни, затем более низкие. При сближении атомов на расстояние а0 образуется устойчивая кристаллическая структура, которой соответствует энергетическая диаграмма, показанная в левой части рисунка. Каждому энергетическому уровню изолированного атома соответствует зона разрешенных энергий: уровню 1s- зона 1s, уровню 2s- зона 2s и т.д. Зоны разрешенных энергий разделены областями запрещенных энергий – запрещенными зонами. С увеличением энергии электрона в атоме ширина разрешенных зон возрастает, а ширина запрещенных зон соответственно уменьшается. Электроны в атоме занимают наиболее низкие энергетические уровни, поэтому соответствующие им зоны также оказываются заполненными. Самую верхнюю из зон, частично или полностью заполненную электронами, называют валентной зоной, а расположенную выше неё свободную от электронов зону называют зоной проводимости
Энергетические диаграммы различных материалов зависят от структуры электронных оболочек изолированных атомов. У атомов, имеющих на внешней оболочке один электрон (литий, натрий, калий), валентная зона заполнена лишь наполовину, поэтому при незначительном энергетическом воздействии электроны переходят на более высокие свободные уровни, что обуславливает хорошую электропроводность этих материалов. У меди, серебра, золота валентная зона и зона проводимости перекрываются друг с другом, создавая смешанную, так называемую гибридную зону, поэтому они также обладают хорошей электропроводностью. У атомов четвертой группы периодической системы элементов (углерод, кремний, германий), имеющих на внешней электронной оболочке по четыре валентных электрона, зона проводимости отделена от валентной зоны запрещенной зоной. В этом случае переход электронов на более высокие энергетические уровни связан с необходимостью внешнего энергетического воздействия, превышающего ширину запрещенной зоны. Материалы, в энергетической диаграмме которых отсутствует запрещенная зона, относятся к категории проводников, материалы с узкой запрещенной зоной (менее 3 эВ) — к категории полупроводников и материалы с широкой запрещенной зоной (более 3 эВ) — к категории диэлектриков