Водородные связи и другие слабые взаимодействия
Водородные связи
Связи Х-Н преимущественно сильно полярны, поэтому протон слабо экранирован и взаимодействует с электронами другого атома:
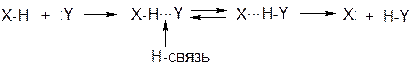
Такие переходы из-за малого энергетического барьера осуществляются легко (подвижность протона).
Энергия Н-связей составляет 10-20 кДж/моль, поэтому при нагревании они разрываются.
Роль водородных связей в физических свойствах ОН-содержащих соединений: вода, спирты, карбоновые кислоты. Гидратация полярных соединений и ионов в водных растворах.
Роль водородных связей в формировании вторичной и третичной структур биополимеров: белков, полисахаридов, НК.
Диполь-дипольное взаимодействие
полярные молекулы могут ассоциироваться так:

сила взаимодействия пропорциональна 3-й степени расстояния.
Повышают т.кип. и т.пл. вещества.
Дисперсионное взаимодействие
неполярные молекулы при тесном сближении взаимодействуют, индуцируя осциллирующие диполи, которые притягиваются друг к другу.

Сила такого взаимодействия пропорциональна 6-й степени расстояния и максимальна на расстоянии ван-дер-ваальсовых радиусов, а также увеличивается при увеличении размера молекулы (длины цепи).
Так происходит ассоциация гидрофобных фрагментов белковых цепей, принимающая участие в формировании вторичной и третичной структур белка. Такое взаимодействие играет большую роль в образовании комплекса лекарственного вещества с рецептором.
ЛИТЕРАТУРА:
Основная
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – ДРОФА, М., 2003 г., с. 39 – 55.
Дополнительная
1.Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М.,
2007 г., с. 24-36.
31.07.09