Теплоёмкость
Известно, что подвод теплоты к рабочему телу в каком-либо процессе сопровождается изменением температуры. Отношение теплоты, подведённой (отведённой) в данном процессе, к изменению температуры называется теплоёмкостью тела.
 ,
,
где dQ – элементарное количество теплоты
dT – элементарное изменение температуры.
Теплоёмкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить температуру на 1 градус. Измеряется в [Дж/К].
Количество теплоты, подведённое к рабочему телу, всегда пропорционально количеству рабочего тела. Например, количество теплоты, необходимое для нагревания на 1 градус кирпича и кирпичной стены неодинаково, поэтому для сравнения вводят удельные величины теплоёмкости, отнеся подведённую теплоту к единице рабочего тела. В зависимости от количественной единицы тела, к которому подводится теплота в термодинамике, различают массовую, объёмную и мольную теплоёмкости.
Массовая теплоёмкость – это теплоёмкость, отнесённая к единице массы рабочего тела,
 .
.
Количество теплоты, необходимое для нагревания 1 кг газа на 1 К называется массовой теплоёмкостью.
Единицей измерения массовой теплоёмкости является Дж/(кг К). Массовую теплоёмкость называют также удельной теплоёмкостью.
Объёмная теплоёмкость – теплоёмкость, отнесённая к единице объёма рабочего тела,
 .
.
Количество теплоты, необходимое для нагревания 1 м3 газа на 1 К называется объёмной теплоёмкостью.
Объёмная теплоёмкость измеряется в Дж/(м3 К).
Мольная теплоёмкость – теплоёмкость, отнесённая к количеству рабочего тела,
 ,
,
где n – количество газа в моль.
Количество теплоты, необходимое для нагревания 1 моль газа на 1 К называется мольной теплоёмкостью.
Мольную теплоёмкость измеряют в Дж/(моль×К).
Массовая и мольная теплоёмкости связаны следующим соотношением:
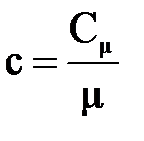 или Сm = mс, где m - молярная масса
или Сm = mс, где m - молярная масса
Теплоёмкость зависит от условий протекания процесса. Поэтому обычно в выражении для теплоёмкости указывается индекс х, который характеризует вид процесса теплообмена.
 .
.
Индекс х означает, что процесс подвода (или отвода) теплоты идёт при постоянном значении какого-либо параметра, например, давления, объёма.
Среди таких процессов наибольший интерес представляют два: один при постоянном объёме газа, другой при постоянном давлении. В соответствии с этим различают теплоёмкости при постоянном объёме Cv и теплоёмкость при постоянном давлении Cp.
1) Теплоёмкость при постоянном объёме равна отношению количества теплоты dQ к изменению температуры dT тела в изохорном процессе (V = const):
 ;
;
2) Теплоёмкость при постоянном давлении равна отношению количества теплоты dQ к изменению температуры dT тела в изобарном процессе (Р = const):

Для понимания сути этих процессов рассмотрим пример.
Пусть имеется два цилиндра, в которых находится по 1 кг одного и того же газа при одинаковой температуре. Один цилиндр полностью закрыт (V = const), другой цилиндр сверху закрыт поршнем, который оказывает на газ постоянное давление Р (P = const).
Подведём к каждому цилиндру такое количество тепла Q, чтобы температура газа в них повысилась от Т1 до Т2 на 1К. В первом цилиндре газ не совершил работу расширения, т.е. количество подведённого тепла будет равно
Qv = cv (T2 – T1) ,
здесь индекс v – означает, что теплота подводится к газу в процессе с постоянным объёмом.
Во втором цилиндре, кроме повышения температуры на 1К, произошло ещё передвижение нагруженного поршня (газ изменил объём), т.е. была совершена работа расширения. Количество подведённого тепла в этом случае определится из выражения:
Qр = cр (T2 – T1)
Здесь индекс р – означает, что тепло подводится к газу в процессе с постоянным давлением.
Общее количество тепла Qp будет больше Qv на величину, соответствующую работе преодоления внешних сил:
Qp – Qv = R,
где R – работа расширения 1 кг газа при повышении температуры на 1К при Т2 – Т1 = 1К.
Отсюда Ср – Сv = R
Если поместить в цилиндр не 1 кг газа, а 1 моль, то выражение примет вид
СmР - Сmv = Rm , где
Rm - универсальная газовая постоянная.
Это выражение носит название уравнения Майера.
Наряду с разностью Ср – Сv в термодинамических исследованиях и практических расчетах широкое применение имеет отношение теплоемкостей Ср и Сv, которое называется показателем адиабаты.
k = Ср / Сv.
В молекулярно – кинетической теории для определения k приводится следующая формула k = 1+2/n,
где n – число степеней свободы движения молекул (для одноатомных газов n=3, для двухатомных n = 5, для трёх и более атомных n = 6).