Ионное произведение воды. Водородный показатель.
Согласно протолитической теории Брэнстеда и Лоури, вода не нейтральный растворитель. Ее молекула может быть донором и акцептором протонов, т.е. является амфолитом. Явление, когда молекулы одного и того же вещества одновременно выступают в качестве кислоты и основания, называются автопротолизом. Сокращенно автопротолиз воды можно записать как процесс ее диссоциации на ионы.
Н2О Н++ОН-
Применяя закон действующих масс, запишем константу диссоциации воды, значение которой можно вычислить по данным измерения электрической проводимости воды.
Кд= 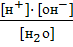 =1,8·10-16 (при 22ºС)
=1,8·10-16 (при 22ºС)
В знаменателе дроби - концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в 1 л, приняв массу 1л воды за 1000г.
[Н2О]= 
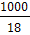 =55,56 молей,
=55,56 молей,
тогда
Кд=  =1,8·10-16
=1,8·10-16
Или [Н+]·[ОН-]=1·10-14 моль-ион/л (ионное произведение воды или константа автопротолиза).
Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10-14 моль-ион/л.
Таким образом, ионное произведение воды позволяет для любого водного раствора найти концентрацию ОН- по известной концентрации Н+, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В нейтральных растворах [Н+]=[ОН-]=√10-14=10-7моль-ион/л. В кислых растворах [Н+]>10-7моль-ион/л, в щелочных [Н+]<10-7моль-ион/л.
Чтобы не писать числа с показателем степени, кислотность раствора выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН.
рН=-lg[Н+], рОН=-lg[ОН-], рН+рОН=14
Величина рН впервые была введена датским химиком С. Серенсоном. Буква «р» - начальная от датского слова potenz (степень), «Н»- символ водорода.
В кислых растворах рН <7, в нейтральных =7, в щелочных >7.
В обычной лабораторной практике рН измеряют с погрешностью 0,02. По этой причине не следует приводить значение рН раствора более чем с двумя цифрами после запятой.
В растворах слабых кислот НА кислотно-основное равновесие имеет вид
НА+Н2О Н3О++А- или
НА Н++А-
Константа кислотной диссоциации (константа кислотности) Ка равна:
Ка=[Н+]· [А-]/[НА]
В растворе слабых оснований В кислотно-основное равновесие имеет вид
В+ Н2О ВН++ОН-
Где В-основание, а ВН+ - сопряженная В кислота. Константа кислотно-основного равновесия в этом случае в соответствии с законом действующих масс равна:
Кb=[BН+]· [ОН-]/[В]
Константу Кb называют константой диссоциации основания В или константой основности.
Величины Ка и Кb для сопряженной кислотно-основной пары связаны также простым соотношением.
Ка Кb=10-14 или рКа+рКb=14, рКb=14-рКа
Таким образом, сила кислот и оснований может быть выражена в общей шкале рКа, подобно тому, как реакция среды характеризуется водородным показателем рН.