ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ И ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
1.1. ВОЗНИКНОВЕНИЕ СКАЧКА ПОТЕНЦИАЛОВ И ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ НА ГРАНИЦЕ МЕТАЛЛ-ЭЛЕКТРОЛИТ
Если металл поместить в раствор его соли (электролит), то начинается переход ионов металла в раствор (окисление) и из раствора в металлический электрод (восстановление). Эти окислительно-восстановительные процессы сопровождаются изменением заряда:
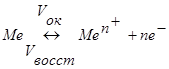
В начальный момент преимущественное направление переходов будет зависеть от соотношения величин энергетических барьеров окисления металла (wok) и восстановления ионов (Wвoccт). Пусть энергетическое состояние катионов характеризуется следующей диаграммой состояния (рис.1.1).
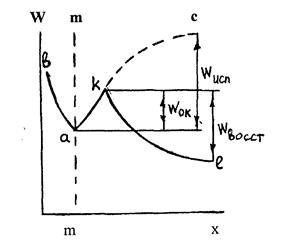
Рис.1.1. Схема изменения энергии при испарении
катиона металла в вакуум и при переходе в раствор электролита:
mm - поверхность раздела металл-электролит,
а - запас энергии катиона на поверхности,
ab - энергия "вдавливания" катиона в металл,
ас - энергия испарения катиона в вакууме (Wисп)
Кl - энергия сольватации катиона в растворе (Wвосст)
Сольватация существенно облегчает переход ионов металла в раствор. Поскольку wboccт > wок, то vboccт <vok - имеет место преимущественный переход ионов металла в раствор. Поверхность металла при этом будет заряжаться отрицательно, а прилегающий к ней слой электролита приобретет положительный заряд. На границе раздела металл-электролит возникает двойной электрический слой, а реализующийся в нем скачок потенциалов затрудняет переход следующих катионов из решетки в раствор (снижается wbocct, возрастает wok). При установившемся равновесном скачке потенциалов и двойном электрическом слое на границе металл-электролит выравниваются скорости и энергетические барьеры окисления металла и восстановления его ионов.
На практике этот случай имеет место, например, в полуэлементе Zn|ZnSО4||.
Если уровень энергии катиона в растворе (1) выше, чем на поверхности металла (а), энергетический барьер окисления выше, чем барьер восстановления, то будет наблюдаться преимущественный переход ионов из раствора в металл и его поверхность зарядится положительно. Такой случай имеет место в полуэлементе Cu|CuSO4||. Поскольку практически всегда энергетические барьеры процессов окисления и восстановления не равны, то при помещении металла в электролит на границе их раздела всегда возникает скачок потенциалов, выравнивающий энергетическое состояние катионов на поверхности металла и в объеме электролита, и появляется двойной электрический слой, включающий заряженную поверхность электродов вместе с прилегающим к электроду противоположно заряженным слоем электролита.