Степень электролитической диссоциации
Если бы электролиты полностью диссоциировали на ионы, то понижение температуры замерзания и другие свойства электролитов всегда были бы в целое число раз больше теоретических значений, рассчитанных по соответствующим формулам. Но еще Вант-Гофф установил, что коэффициент I выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует в растворе на ионы, и ввел понятие степени диссоциации.
Степенью диссоциации электролита 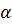 называется отношение числа его молекул, распавшихся на ионы n, к общему числу его молекул, введенных в раствор N:
называется отношение числа его молекул, распавшихся на ионы n, к общему числу его молекул, введенных в раствор N:
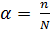 ,
,
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
По своей природе электролиты можно разделить на три группы: сильные, средней силы и слабые электролиты. Отнесение электролита к той или иной группе основано на экспериментально определяемом по электропроводности его 0,1 н. раствора при 25 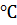 значении степени электролитической диссоциации.
значении степени электролитической диссоциации.
Сильные электролиты в водных растворах диссоциируют практически полностью. Для сильных электролитов 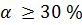 .
.
Электролиты средней силы диссоциируют лишь частично. Для сильных электролитов 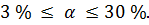
Слабые электролиты диссоциируют на ионы в очень малой степени; в растворах они находятся преимущественно в виде молекул. Для слабых электролитов 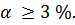
В таблице 2 приведены примеры электролитов различной силы.
Табл. 2. Электролиты
| Кислоты | ||
| Сильные | Средней силы | Слабые |
| HCl | HF | H2CO3 |
| HBr, HI | H3PO4 | H2S |
| H2SO4 | H2SO3 | HCN |
| HNO3 | HCOOH | CH3COOH |
| HClO4 | И многие другие органические кислоты | |
| HMnO4 |
| Основания | ||
| Сильные | Средней силы | Слабые |
| NaOH | Mg(OH)2 | NH4OH |
| KOH, RbOH, CsOH | Cu(OH)2 | |
| Ca(OH)2 | Fe(OH)3 | |
| Sr(OH)2, Ba(OH)2 | И другие гидроксиды d-элементов, органические основания |
| Соли | ||
| Сильные | Средней силы | Слабые |
| Многие соли с ионной кристаллической решеткой | Различные соли в зависимости от разбавления раствора | Немногие соли (например, CuCl2, Fe(CNS)3) |
| NaCl | ||
| Al2(SO4)3 |
Степень диссоциации 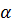 зависит:
зависит:
1) От природы реагирующих веществ.
2) От природы растворителя.
Так, например, известно, что HCl хорошо диссоциирует в полярном растворителе − воде, в малополярном растворителе − этаноле C2H5OH – значительно хуже и совсем не диссоциирует в неполярном растворителе − бензоле C6H6. Таким образом, 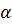 зависит от полярности молекул растворителя.
зависит от полярности молекул растворителя.
3) От температуры.
С ростом температуры 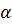 возрастает.
возрастает.
4) От концентрации растворенного вещества.
С разбавлением раствора (то есть с уменьшением его концентрации) 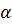 возрастает. Математическим выражением этой зависимости является закон разбавления Оствальда.
возрастает. Математическим выражением этой зависимости является закон разбавления Оствальда.