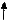Схема подразделения энергетических уровней на подуровни
  |
Электронные формулы – показывают распределение электронов по энергетическим уровням и подуровням.
число впереди формулы– номер уровня;
буква– подуровень (тип орбитали);
индекс справа вверху– число электронов на подуровне.
5.3.Основные положения строения электронных оболочек атома
| Принцип Паули | |
| В каждой орбитали может находиться не более 2-х электронов. В атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. | Если в орбитали 1 электрон – это неспаренный электрон. Если в орбитали 2 электрона, то это спаренные электроны. |
| Правило Гунда | |||||||||||
| Порядок заполнения электронами подуровней формулируется правилом Гунда: в подуровнях p-, d- и f-орбитали сначало заполняются одиночными, неспаренными электронами и лишь потом происходит их заполнение вторыми электронами, т.е. спаривание. Иными словами, при заполнении электронами подуровня суммарное спиновое число подуровня должно быть максимальным. | Например, состояние (I) имеет суммарное спиновое число Sms = +1/2–1/2+1/2=+1/2, а состояние (II) того же подуровня с тем же числом электронов имеет Sms = +1/2+1/2+1/2=+3/2. Второму состоянию отвечает большее суммарное спиновое число, и это состояние предпочтительнее первого.

p p I II |
| Правило Клечковского | |
Сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и  является наименьшей. является наименьшей.
| Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом  . .
|
| Принцип наименьшей энергии | |
| При заполнении электронами уровней и подуровней последовательность размещения электронов в атоме должна отвечать как наименьшей энергии электрона, так и наименьшей энергии атома в целом. Электрон не занимает вышележащий уровень, если в нижележащем уровне есть места, располагаясь на которых, он будет обладать меньшей энергией. | Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули. |
Максимальное число электронов:
– на орбитали (определенные n,  , , ) – 2
подуровень s p d f
максимальное число электронов 2 6 10 14
– на подуровне(определенные n и ) – 2
подуровень s p d f
максимальное число электронов 2 6 10 14
– на подуровне(определенные n и  ) – 2 (2 ) – 2 (2  +1)
– на уровне – 2n2 +1)
– на уровне – 2n2
|
«Проскок» электрона: формула 24Cr 1s2 2s2 2p6 3s2 3p6 3d4 4s2 не соответствует действительности, т.к. второй электрон с внешнего уровня «перескочил» на d-подуровень второго снаружи уровня → 24Cr 1s2 2s2 2p6 3s2 3p6 3d5 4s1.
«Проскок» электрона характерен на d-орбитали, так как более устойчивыми состояниями являются размещение 5-ти или 10-ти электронов. То же у f-орбитали – 7 или 10 электронов.