Металлические конструкции
Под коррозией металлов понимается процесс их разрушения, вызванный химическим или электрохимическим воздействием среды.
Наиболее распространенным примером коррозии является образование ржавчины как продукта окисления железа, алюминия, меди и т. д. Разрушение металлов под влиянием кислорода воздуха, воды, кислот, растворов солей часто называют «незримым пожаром», распространяющимся всюду, где имеется металл.
Коррозия является сильным бичом металлов. Потери от нее громадны. Несмотря на применяемую защиту, ежегодно превращается в ржавчину около 10 %, или более 10 млн т металла. Однако эти прямые потери не отражают истинного объема всех потерь. Ведь от коррозии гибнет не просто металл, а строительные конструкции, стоимость которых намного выше стоимости металла, израсходованного на них. Ущерб от коррозии измеряется не только потерей металла и огромными затратами на очистку, ремонт, замену металлических изделий и конструкций, но и потерей надежности и эксплуатационной пригодности строительных объектов.
Классы среды по условиям эксплуатации при воздействии на металлические конструкции атмосферы воздуха, жидких неорганических сред, солей и аэрозолей и для эксплуатации металлических конструкций в гру-нтах представлены, соответственно, в таблицах 5.20–5.24.
Таблица 5.20 – Классы среды по условиям эксплуатации при воздействии атмосферы воздуха на металлические конструкции
| Влажностный режим помещений по ТКП 45-2.04-43 | Группа газов по таблице А.1 (приложение А) | Класс среды по условиям эксплуатации при воздействии атмосферы воздуха на металлические конструкции | ||||
| Район (подрайон) влажности по СНБ 2.04.02 | внутри отапливаемых зданий | внутри неотапливаемых зданий или под навесами | на открытом воздухе | |||
| Сухой | А В С D | ХА0 ХА0 ХА1 ХА2 | ХА0 ХА1 ХА2 ХА2 | ХА1 ХА1 ХА2 ХА3 | ||
| Нормально-сухой | ||||||
| Нормальный | А В С D | ХА0 ХА1 ХА2 ХА2 | ХА1 ХА2 ХА2 ХА3 | ХА1 ХА2 ХА2 ХА3 | ||
| Нормально-влажный | ||||||
| Влажный, мокрый | А В С D | ХА1 ХА2 ХА2 ХА2 | ХА2 ХА2 ХА3 ХА3 | ХА2 ХА2 ХА3 ХА3 | ||
| Влажный | ||||||
| Примечания 1 При оценке класса среды по условиям эксплуатации влияние углекислого газа не учитывается. 2 При оценке класса среды по условиям эксплуатации для алюминиевых конструкций влияние сернистого газа, сероводорода, окислов азота и аммиака в концентрациях по группам А и В не учитывается; во влажной зоне при газах группы А класс среды по условиям эксплуатации следует оценивать как ХА1. | ||||||
Таблица 5.21 – Классы среды по условиям эксплуатации при воздействии жидких органических сред на металлические конструкции
| Органические жидкие среды | Класс среды по условиям эксплуатации при воздействии среды на металлические конструкции |
| Масла (минеральные, растительные, животные) | ХА0 |
| Нефть и нефтепродукты | ХА1 |
| Растворители (бензол, ацетон) | ХА1 |
| Растворы органических кислот | ХА3 |
| Примечание – Класс среды по условиям эксплуатации для нефти и нефтепродуктов указан при воздействии на поддерживающие металлические конструкции и наружную поверхность конструкций резервуаров. |
Таблица 5.22 – Классы среды по условиям эксплуатации при воздействии
солей и аэрозолей на металлические конструкции
| Влажностный режим помещений по ТКП 45-2.04-43 | Характеристика солей, аэрозолей и пыли | Класс среды по условиям эксплуатации при воздействии среды на металлические конструкции | ||||
| Район (подрайон) влажности по СНБ 2.04.02 | внутри отапливаемых зданий | внутри неотапливаемых зданий или под навесами | на открытом воздухе | |||
| Сухой | Малорастворимые | ХА0 | ХА0 | ХА1 | ||
| Нормально-сухой | Хорошо растворимые малогигроскопичные | ХА0 | ХА1 | ХА1 | ||
| Хорошо растворимые гигроскопичные | ХА1 | ХА1 | ХА2 | |||
| Нормальный | Малорастворимые | ХА0 | ХА1 | ХА1 | ||
| Нормально-влажный | Хорошо растворимые малогигроскопичные | ХА1 | ХА2 | ХА2 | ||
| Хорошо растворимые гигроскопичные | ХА2 | ХА2 | ХА2 | |||
| Влажный или мокрый | Малорастворимые Хорошо растворимые малогигроскопичные Хорошо растворимые гигроскопичные | ХА0 ХА1 ХА2 | ХА1 ХА2 ХА2 | ХА1 ХА2 ХА3 | ||
| Влажный | ||||||
| Примечание – Для частей ограждающих конструкций, находящихся внутри зданий, класс среды по условиям эксплуатации следует устанавливать как для помещений с влажным или мокрым режимом. | ||||||
Таблица 5.23 – Классы среды по условиям эксплуатации при воздействии жидких неорганических сред на металлические конструкции
| Неорганические жидкие среды | Водородный показатель рН | Суммарная концентрация сульфатов и хлоридов, г/л | Класс среды по условиям эксплуатации при воздействии сред на металлические конструкции при свободном доступе кислорода в интервале температур от 0 до 50 °С и скорости движения до 1 м/с |
| Пресные природные воды | Св. 3 до 11 включ. | До 5 включ. | ХА2 |
| Св. 5 | ХА3 | ||
| До З включ. | Любая | ХА3 | |
| Минерализованная вода | Св. 6 до 8,5 включ. | Св. 20 до 50 включ. | ХА2 |
| Производственные оборотные и сточные воды без очистки | Св. 3 до 11 включ. | До 5 включ. Св. 5 | ХА2 ХА3 |
| Сточные жидкости животноводческих зданий | Св. 5 до 9 включ. | До 5 включ. | ХА2 |
| Растворы неорганических кислот | До 3 включ. | Любая | ХА3 |
Окончание таблицы 5.23
| Неорганические жидкие среды | Водородный показатель рН | Суммарная концентрация сульфатов и хлоридов, г/л | Класс среды по условиям эксплуатации при воздействии сред на металлические конструкции при свободном доступе кислорода в интервале температур от 0 до 50 °С и скорости движения до 1 м/с |
| Растворы щелочей | Св. 11 | Любая | ХА2 |
| Растворы солей конце-нтрацией св. 50 г/л | Св. 3 до 11 включ. | Любая | ХА3 |
| Примечание – При насыщении воды хлором или сероводородом следует принимать класс среды по условиям эксплуатации на одну ступень выше. |
Таблица 5.24 – Классы среды по условиям эксплуатации для металлических конструкций в грунтах
| Средняя годовая температура воздуха, °С* | Характеристика грунтовых вод** | Класс среды по условиям эксплуатации для грунтов ниже уровня грунтовых вод | Класс среды по условиям эксплуатации для грунтов выше уровня грунтовых вод*** | ||||
| рН | суммарная концентрация сульфатов и хлоридов, г/л | в районах (подрайонах) влажности по СНБ 2.04.02 | при значениях удельного сопротивления грунтов, Ом | ||||
| до 20 | св. 20 | ||||||
| Св. 0 до 6 включ. | До 5 включ. | Любая | ХА3 | Влажный | ХА3 | ХА2 | |
| Св. 5 | До 1 включ. | ХА1 | Нормально-сухой | ХА2 | ХА1 | ||
| Св. 5 | Св. 1 | ХА2 | Нормально-влажный | ХА3 | ХА2 | ||
| Св. 6 | До 5 включ. | Любая | ХА3 | Влажный | ХА3 | ХА3 | |
| Св. 5 | До 5 включ. | ХА2 | Нормально-сухой | ХА2 | ХА2 | ||
| Св. 5 | Св. 5 | ХА3 | Нормально-влажный | ХА3 | ХА2 | ||
| * ** *** | Средняя годовая температура воздуха определяется по СНБ 2.04.02. Не рассматривается воздействие геотермальных вод. Для сильнофильтрующих и среднефильтрующих грунтов с коэффициентом фильтрации св. 0,1 м/сут. | ||||||
По механизму протекания коррозию разделяют на химическую и электрохимическую.
По условиям протекания различают коррозию:
– газовую, обычно протекающую при высоких температурах;
– в неэлектролитах (бензин, керосин и т. д.);
– в электролитах (солях, кислотах, щелочах) при полном, частичном или периодическом погружении, в движущейся или покоящейся среде;
– в естественных природных условиях (атмосферную, морскую, подземную);
– под воздействием внешнего тока (электрокоррозию);
– радиохимическую (под воздействием радиоактивного излучения);
– биологическую (под воздействием продуктов жизнедеятельности микроорганизмов);
– фреттинг-коррозию, или коррозионную эрозию (при одновременном воздействии коррозионной среды и сил трения);
– при кавитации (ударном воздействии коррозионной среды);
– контактную (при контакте металлов, имеющих различные потенциалы);
– щелевую, протекающую в узких щелях и зазорах между отдельными деталями;
– структурную, обусловленную структурной неоднородностью сплава;
– термоконтактную, возникающую за счет температурного градиента, обусловленного неравномерным нагреванием поверхности металла.
По характеру коррозионных поражений различают спло-шную (или общую) и местную коррозию.
Основные виды коррозии стальных строительных конструкций по характеру коррозионных поражений представлены в таблице 5.25.
Сплошная коррозия характеризуется относительно равномерным по всей поверхности постепенным проникновением вглубь металла, т. е. уменьшением толщины сечения элемента или толщины защитного металлического покрытия.
Коррозия пятнами (неравномерная) характеризуется небольшой глубиной проникновения коррозии по сравнению с поперечными (в поверхности) размерами коррозионных поражений, отдельные участки конструкций покрываются продуктами коррозии, как и при сплошной коррозии.
Язвенная коррозия характеризуется появлением на поверхности конструкции отдельных или множественных повреждений, глубина и поперечные размеры которых (от долей миллиметра до нескольких миллиметров) соизмеримы. Язвенная коррозия обычно сопровождается образованием толстых слоев продуктов коррозии, покрывающих всю поверхность металла или значительные ее участки вокруг отдельных крупных язв (характерно для коррозии незащищенных конструкций в грунтах).
Точечная (питтинговая) коррозия характеризуется появлением на поверхности конструкций отдельных мелких (не более 1 мм в диаметре) и глубоких (глубина больше поперечных размеров) язвочек.
Межкристаллитная коррозия характеризуется относительно равномерным распределением множественных трещин на больших участках поверхности конструкций, особенно в зоне сварки. Глубина трещин обычно меньше, чем их размеры на поверхности.
Коррозионное растрескивание – вид квазихрупкого разрушения стали при одновременном воздействии статистических напряжений растяжения и агрессивных сред, характеризуется образованием единичных и множественных трещин, связанных с концентрацией основных рабочих и внутренних напряжений. Трещины могут распространяться между кристаллами или по телу зерен, но с большей скоростью в плоскости, нормальной к действующим напряжениям, чем в плоскости поверхности.
Таблица 5.25 – Основные виды коррозии стальных строительных
конструкций по характеру разрушения
| Наименование вида коррозии | Эскиз | Предельное значение | |
| Сплошная | 
| Не допускается | |
| Пятнами (равномерная) | 
| Не допускается | |
| Язвенная | 
| hя £ 0,5 мм, dя £ 2 мм | |
| Точечная (питтинговая) | 
| d £ 0,1 мм | |
| Межкристаллитная | 
| Не допускается | |
| Щелевая и контактная | 
| а £ 0,2 мм | |
| Коррозионное растрескивание и коррозионная усталость | 
| Не допускается |
Коррозионная усталость – вид квазихрупного разрушения материалов при одновременном воздействии циклических напряжений и жидких агрессивных сред. Она характеризуется теми же внешними признаками, что и коррозионное растрескивание.
Контактная коррозия выражается в резком, чаще всего в местном увеличении глубины проникновения сплошной коррозии одного из двух разнородных металлов или сплавов, между которыми существует электрический контакт за счет металлической связи одновременного воздействия одной и той же электропроводной среды (электролита) на оба металла или сплава.
Щелевая коррозия в чистом виде присуща конструкциям из нержавеющей стали в агрессивных жидких средах, в которых материалы вне узких щелей и зазоров устойчивы благодаря пассивному состоянию, т. е. вследствие образования на их поверхности защитной пленки. Из-за недостаточного доступа кислорода в узкие щели и зазоры пассивное состояние стали в них неустойчиво, металл в щелях становится анодным по отношению к металлу вне щелей и зазоров, коррозия протекает подобно контактной.
5.6.2.1 Показатели коррозии.В настоящее время известны различные показатели (критерии) оценки степени или скорости коррозии металлов. К наиболее часто используемым относятся.
Прямые показатели коррозии:
– убыль или увеличение массы, отнесенные к единице поверхности металла;
– глубина коррозии;
– доля поверхности, занятая продуктами коррозии;
– количество коррозионных язв или точек на единице поверхности;
– объем выделившегося с единицы поверхности водорода или поглощенного кислорода;
– время до появления первого очага коррозии;
– время до появления коррозионной трещины или полного разрушения образца;
– сила тока коррозии.
Косвенные показатели коррозии:
– изменение физико-механических свойств металла (предела прочности при испытаниях на сжатие и разрыв, относительного удлинения, отражательной способности и др.);
– изменение электросопротивления.
Некоторые из приведенных показателей, отнесенные к времени развития коррозионного процесса, выражают скорость коррозии, например в случае равномерной коррозии ее скорость может быть определена по формуле
 ,
,
| где | 
| – | убыль (увеличение) массы; | |
| S | – | площадь поверхности; | ||
| t | – | время. | ||
Обычно v выражают в таких единицах: г/(м2·ч) или мг/(см2·сут). Весовой показатель не всегда удобен, особенно если сравнивается коррозия металлов разной плотности. В таких случаях лучше пользоваться глубинным показателем коррозии, т. е. средней глубиной проникновения кор-розионного разрушения в металл, мм/год:
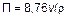 ,
,
| где | 8,76 | – | коэффициент для перехода от измерения весового показателя скорости коррозии в расчете на 1 ч к глубинному показателю в расчете на 1 год (24 ч х 360 = 8760 ч); | |
| v | – | скорость коррозии, г/(м2 ·ч); | ||
| r | – | плотность, г/см3. | ||
В том случае, если коррозия имеет местный характер, скорость ее не может быть точно охарактеризована весовым или глубинным показателем. При питтинговой коррозии необходимо определять максимальный глубинный показатель. При межкристаллитной коррозии и коррозионном растрескивании скорость коррозии количественно характеризуется механическим показателем коррозии, например по потере прочности:
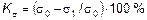 ,
,
где  – предел прочности до коррозии;
– предел прочности до коррозии;
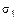 – предел прочности после коррозии, рассчитанный по отношению к первоначальной площади сечения металлического образца.
– предел прочности после коррозии, рассчитанный по отношению к первоначальной площади сечения металлического образца.
Для грубой оценки коррозионной стойкости металлов существует десятибалльная шкала (таблица 5.26).
Таблица 5.26 – Оценка коррозионной стойкости металлов
| Группа стойкости | Глубинный показатель коррозии, мм/год | Балл |
| Совершенно стойкие | 0,001 | |
| Весьма стойкие | 0,001–0,005 | |
| 0,005–0,010 | ||
| Стойкие | 0,01–0,05 | |
| 0,05–0,10 | ||
| Пониженностойкие | 0,1–0,5 | |
| 0,5–1,0 | ||
| Малостойкие | 1,0–5,0 | |
| 5,0–10,0 | ||
| Нестойкие | 10,0 |
5.6.2.2 Химическая коррозия.Наиболее важным видом химической коррозии является газовая коррозия. Реакции, протекающие при сопри-косновении металлоконструкций с кислородом или другими окисля-ющими газами при высокой температуре (свыше 100 °С):

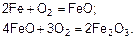
Металлы менее активны по отношению к кислороду при высоких температурах, чем при низких. При нагревании оксида металла до определенной температуры происходит его диссоциация (разложение). Оксид образуется на поверхности металлоконструкций, если давление диссоциации меньше, чем давление кислорода в окружающей среде. У оксида железа 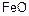 давление диссоциации очень мало даже при температуре 2000 °С, поэтому окисление стальных конструкций происходит и при более высоких температурах. Аналогично ведут себя алюминиевые, медные, никелевые конструкции.
давление диссоциации очень мало даже при температуре 2000 °С, поэтому окисление стальных конструкций происходит и при более высоких температурах. Аналогично ведут себя алюминиевые, медные, никелевые конструкции.
Если в результате химической коррозии образуется сплошная оксидная пленка, имеющая достаточно прочную адгезию с поверхностью металлоконструкции, то доступ кислорода к металлу затрудняется, коррозия замедляется, а затем и совсем прекращается. Пористая, плохо связанная с поверхностью конструкции оксидная пленка не защищает металл от коррозии. Когда объем оксида больше объема вступившего в реакцию окисления металла и оксид имеет достаточную адгезию с поверхностью металлоконструкции, такая пленка хорошо защищает металл от дальнейшего разрушения. Толщина защитной пленки оксида колеблется от нескольких молекулярных слоев (5 ¼ 10)×10–5 м до нескольких микронов.
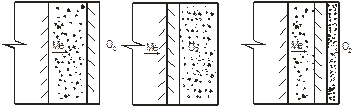
Толщина оксидной пленки увеличивается только в том случае, если через нее диффундирует кислород. Если ионы металла и принадлежащие им электроны диффундируют из металла через оксидную пленку намного быстрее, чем кислород, то толщина оксидной пленки увеличивается над границей газа и оксида (рисунок 5.2).
| а) | б) | в) |
| ||
| Рисунок 5.2 – Схема роста оксидной пленки при газовой коррозии: а – рост пленки со стороны газовой среды; б – то же, со стороны поверхности металла; в – то же, между поверхностью металла и средой |
Обычно в условиях эксплуатации наблюдается именно такой механизм роста оксидной пленки металла, так как размер ионов самого металла меньше молекул кислорода. Окисление материала металлоконструкций, соприкасающихся с газовой средой, происходит в котлах, дымовых трубах котельных, водонагревателях, работающих на газовом топливе, теплообменниках, работающих на жидком и твердом топливе.
Если бы газообразная среда не содержала диоксида серы или других агрессивных примесей, а взаимодействие металлоконструкций со средой происходило при постоянной температуре по всей плоскости конструкции, то относительно толстая оксидная пленка служила бы достаточно надежной защитой от дальнейшей коррозии.
В действительности распределение температуры по поверхности и объему металла неодинаково, особенно в чугунных котлах, работающих на газовом топливе. В связи с тем, что тепловое расширение металла и оксида различно, оксидная пленка отслаивается местами, что создает условия для дальнейшей коррозии. При взаимодействии со стальной конструкцией диоксида серы, содержащегося в продуктах горения топлива, образуется сульфид железа, который при высокой температуре разлагается и окисляет металл. Вторичный оксид железа, который сопровождает этот процесс, более пористый и не защищает металл от дальнейшей коррозии. Коррозия металла ускоряется диоксидом углерода.
Интенсивность газовой коррозии зависит от свойств и скорости движения газов или воздушной среды, их температуры, равномерности нагрева материала конструкции и др. Для сплавов значительное влияние на скорость коррозии оказывает разница в интенсивности окисления различных компонентов. При нагревании стальных конструкций в результате контакта их с газообразной средой, содержащей кислород, диоксид углерода или водяные пары, окисление происходит по одной из нижеприведенных реакций:
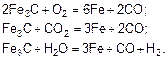
Содержание углерода в поверхностном слое конструкции уменьшается, и сталь превращается в мягкое железо – обезуглероживается. Так как углерод в стали диффундирует быстрее, чем ионы металла, из сплава на поверхность выходят все новые и новые атомы углерода, которые окисляются до оксида углерода. Вследствие этого сталь приобретает свойство текучести и конструкция сильно деформируется, а затем разрушается.
Газовая коррозия стальных конструкций может протекать вследствие не только окислительных, но и восстановительных процессов. При сильном нагреве стальных конструкций под высоким давлением в среде, содержащей водород, водород диффундирует в объем стали и разрушает материал по двойному механизму – обезуглероживания стали из-за взаимодействия водорода с углеродом и придания стали свойств хрупкости вследствие растворения в ней водорода – «водородная хрупкость»:
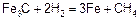 .
.
На скорость газовой коррозии металлов влияют внутренние факторы: природа металла, химический и фазовый состав сплава, механические напряжения и деформация, а также внешние факторы: состав и давление газовой среды, скорость ее движения, температура, режим нагрева.
Состав и структура сплава. Увеличение содержания углерода в сталях уменьшает скорость их окисления. Сера и фосфор на скорость окисления влияют незначительно. Добавки хрома, алюминия и кремния замедляют процесс окисления. Легирование титаном, медью, кобальтом и бериллием менее эффективно. Ванадий, молибден, вольфрам ускоряют окисление стали. Скорость окисления меди снижается добавками алюминия, бериллия, олова и цинка.
На скорость окисления влияет структура сплава. Наиболее жаростойкой является сталь с аустенитной структурой. С увеличением содержания ферритной составляющей скорость окисления стали возрастает. Жаростойкость чугунов зависит от формы графитовых включений. При шаровидной форме графита жаростойкость чугуна выше, чем при любой другой.
Деформация металла при нагреве может вызвать разрушение оксидных пленок и увеличить скорость окисления.
Состав газовой среды. При высоких температурах металлы могут взаимодействовать с кислородом, парами воды, оксидом углерода (IV) и оксидом серы (IV).
При этом скорости окисления железа, кобальта и никеля (при температуре 900 °С) возрастают в ряду  . В отличие от указанных металлов медь практически не корродирует в
. В отличие от указанных металлов медь практически не корродирует в 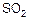 , вольфрам слабо корродирует в
, вольфрам слабо корродирует в 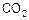 .
.
В среде перечисленных газов скорость газовой коррозии возрастает в ряду 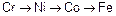 .
.
Примеси. Примеси  в воздухе значительно увеличивают скорость газовой коррозии малоуглеродистой стали.
в воздухе значительно увеличивают скорость газовой коррозии малоуглеродистой стали.
При нагревании в атмосфере 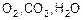 кроме окисления может происходить обезуглероживание. Последнее возможно также в атмосфере, содержащей водород. В атмосфере
кроме окисления может происходить обезуглероживание. Последнее возможно также в атмосфере, содержащей водород. В атмосфере  наоборот, может происходить науглероживание.
наоборот, может происходить науглероживание.
Температура. С увеличением температуры для металлов происходит снижение термодинамической возможности окисления. При этом константа скорости реакции окисления возрастает, а это приводит к увеличению скорости газовой коррозии.
Большое влияние на скорость окисления металлов оказывает режим нагрева. Колебания температуры при нагреве (особенно при попеременном нагреве и охлаждении) вызывают разрушение оксидных пленок и увеличение скорости газовой коррозии.
5.6.2.3 Электрохимическая коррозия.Процесс коррозии металлов в подавляющем большинстве случаев имеет электрохимический механизм, для действия которого необходимо присутствие влаги на поверхности металла.
Электрохимическая коррозия металлических конструкций приводит к наибольшим разрушениям. Это объясняется тем, что среда, в которой она происходит (электролит, представляющий грунтовую или атмосферную влагу, морскую или водопроводную воду), очень широко распространена в производственных процессах и быту. Электрохимическая коррозия возникает при соприкосновении металлов с электролитами, т. е. с растворами, обладающими электропроводностью.
Сущность электрохимической коррозии состоит в деятельности гальванических микро- и макроэлементов: разнородные металлы, находясь в электролите, вызывают коррозию, которая является следствием работы коррозионных гальванических элементов или пар с замкнутой цепью.
При контакте с воздухом на поверхности конструкции появляется тонкая пленка влаги, в которой растворяются примеси, находящиеся в воздухе, например диоксид углерода. При этом образуются растворы, вызывающие электрохимическую коррозию.
Электрохимическая коррозия – явление сложное, состоящее из нескольких процессов. На анодных участках протекает анодный процесс – в раствор переходят ионы металла (Me), а избыточные электроны (е), оставаясь в металле, движутся к катодному участку. Схема этого процесса следующая:
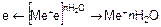 .
.
На катодных участках поверхности металла избыточные электроны поглощаются ионами, атомами или молекулами электролита (деполяризаторами), которые восстанавливаются:
 ,
,
где Д – деполяризатор;
е – электрон.
Интенсивность коррозионного электрохимического процесса зависит от скорости анодной реакции, при которой ион металла переходит из кристаллической решетки в раствор электролита, и катодной, заключающейся в ассимиляции освобождающихся при анодной реакции электронов. Возможность перехода иона металла в электролит определяется силой связи с электронами в междоузлиях кристаллической решетки. Чем сильнее связь между электронами и атомами, тем труднее вызвать переход иона металла в электролит.
В электролитах имеются положительно заряженные частицы – катионы и отрицательно заряженные – анионы. Анионы и катионы присоединяют к себе молекулы воды. Структура молекул воды обусловливает ее полярность (рисунок 5.3).

|
| Рисунок 5.3 – Строение молекулы воды |
Между заряженными ионами и полярными молекулами воды во-зникает электростатическое вза-имодействие, вследствие которого полярные молекулы воды определенным образом ориентируются вокруг анионов и катионов (рисунок 5.4).
При переходе ионов металлов из кристаллической решетки в раствор электролита освобождается эквивалентное число электронов. Таким образом, на границе металл – электролит образуется двойной электрический слой, в котором металл заряжен отрицательно, электролит – положительно; возникает скачок потенциала.
Способность ионов металла переходить в раствор электролита характеризуется электродным потенциалом, который представляет собой энергетическую характеристику двойного электрического слоя. Когда этот слой достигает разности потенциалов, переход ионов в раствор прекращается и наступает равновесное состояние.

Рисунок 5.4 – Гидратация ионов:
А- – анод; К+ – катод; n – полярные молекулы воды
Потенциалы металлов, находящиеся в растворе в равновесии с собственными ионами, называются равновесными. Величина равновесного электродного потенциала зависит от природы металла и раствора, температуры и активности ионов металла в электролите. Когда активность ионов металла в растворе равна единице, а температура электролита 25 °С, значение потенциала данного металла соответствует стандартному.
Ниже приведены стандартные электродные потенциалы некоторых металлов, В:
Аl/Аl3+ –1,66 Fe/Fe3+ –0,037
Zn/Zn2+ –0,762 V2(H2)H+ 0,000
Fe/Fe2+ –0,440 Cu/Cu2+ +0,337
По значениям этих величин можно определить электродвижущую силу элемента, составленного из двух разноименных металлов. Например, для элемента из медного и цинкового электродов, погруженных в растворы собственных ионов с активностью 1 г·ион/л, электродвижущая сила  В.
В.
При электрохимической коррозии на одних участках металлоконструк-ции протекают анодные, на других – катодные процессы. При этом на ка-тодных участках вода и растворенный в ней кислород присоединяют свободные электроны, образуя гидроксильную группу:
 .
.
Если в электролите много гидроксильных групп или раствора кислот, возможен также катодный процесс нейтрализации ионов водорода:
 .
.
Эта реакция вследствие накопления молекул водорода сильно замедляется в случае прекращения окисления водорода. Процессы окисления водорода протекают в присутствии кислорода воздуха, который под влиянием металлического катализатора вступает в реакцию с водородом, образуя воду:
 .
.
Продукты коррозии являются результатом вторичных процессов взаи-модействия гидратированных ионов с кислородом. Если они хорошо растворимы, то могут переноситься от места их образования. Если же труднорастворимы, какими являются, как правило, продукты коррозии стали, то откладываются на ее поверхности, образуя более или менее четко выраженный растущий слой ржавчины, которая состоит из оксидов и гидроксидов железа.
Если катодный процесс протекает беспрепятственно, то и разрушение на аноде происходит не затухая. Однако в процессе работы коррозионных элементов изменяются их поверхности, уменьшается разность потенциалов, коррозия затухает, и это называется поляриза-цией. Данный процесс полезен для защиты металла от коррозии; он обусловлен «обрастанием» электрода пузырьками водорода и пленками из продуктов коррозии. Поляризация может происходить как за счет смещения потенциала анода в положительную сторону (анодная поляризация), так и за счет смещения потенциала катода в отрицательную сторону (катодная поляризация). Вещества, которые вступают в реакцию с поляризаторами и тем самым усиливают коррозию, называются деполяризаторами, а сам процесс – деполяризацией.Например, приток кислорода к катоду вызывает реакцию с водородом, приводит к образованию воды и освобождению поверхности катода для развития гальванического процесса. Там, где имеется доступ кислорода к конструкции, коррозия не прекращается, если ее не задерживают окисные пленки – продукты коррозии.
Разрушению в электролите подвергаются не все металлы, а только электрохимически неоднородные, создающие гальванические пары. Под электрохимической неоднородностью понимается наличие разных электродных потенциалов в разных точках поверхности металлической конструкции, обусловленное неоднородностью самого металла и окружающей его среды, играющей роль электролита.
При длительной эксплуатации конструкции во влажной или водной среде на ее поверхности образуется несколько слоев ржавчины. Самый глубокий – оксид типа FeO, затем магнетит Fe3О4, гидратированный магнетит  и обычная красно-коричневая ржавчина
и обычная красно-коричневая ржавчина  , расположенная непосредственно на границе с электролитом. Так как доступ кислорода к более глубоким слоям оболочки из продуктов коррозии затруднен, в них образуются оксиды железа высшей валентности.
, расположенная непосредственно на границе с электролитом. Так как доступ кислорода к более глубоким слоям оболочки из продуктов коррозии затруднен, в них образуются оксиды железа высшей валентности.
При образовании оксидов железа с валентностью ниже трех соединения также осаждаются на расстоянии нескольких молекулярных диаметров от анода и представляют собой рыхлый осадок, плохо сцепленный с поверхностью металла. Образовавшийся слой ржавчины приводит к дальнейшей коррозии.
Электрохимическая коррозия возникает также при повреждении на отдельных участках оксидной или другой защитной пленки, в этом случае оксидная пленка служит катодом, на котором под действием кислорода образуются ионы гидроксида, а оголенная поверхность металла становится анодом.
Локальными коррозионными элементами могут быть микроскопиче-ские или субмикроскопические примеси на микроскопически однородной поверхности. Любое загрязнение, например чужеродный металл, осаждающийся на поверхности металлической конструкции, вызывает появление электродного потенциала и служит причиной начала коррозионного процесса.
Наиболее опасными, вызывающими точечную коррозию, являются процессы неравномерной аэрации, сопровождающие неодинаковую скорость доставки кислорода к различным участкам конструкции. Участки, плохо снабжающиеся кислородом, становятся анодами и разрушаются.
Процессы точечной коррозии характерны для неравномерной аэрации в объеме электролита, представленного каплей. Это явление, например, для стальной не оцинкованной кровли объясняется следующим. Сталь при окислении быстро поглощает растворенный в капле кислород. Соприкасающаяся с воздухом кромка капли снабжается кислородом более интенсивно по сравнению с центральной частью, куда доступ кислорода затруднен. В середине капли железо под действием сил гидратации будет переходить в раствор капли в виде двухвалентного иона:
 .
.
На кромках капли в это время протекает процесс
 .
.
Образующиеся гидроксил-ионы диффундируют внутрь капли, где вступают во взаимодействие с ионами двухвалентного железа. В результате реакции образуется гидроксид железа, который в дальнейшем при взаимодействии с кислородом переходит в ржавчину.
Точечная коррозия образуется также там, где анодами становятся относительно небольшие участки поверхности конструкции, покрытые адсорбированными пузырьками газа или другого инертного по отношению к материалу конструкции вещества. Под такими частичками кислород быстро иссякает, дальнейшее его поступление по сравнению с другими участками затруднено, вследствие чего образовавшиеся аноды быстро разрушаются, вызывая точечные поражения поверхности конструкций.
Интенсивность коррозионных процессов в большинстве случаев является функцией активности ионов водорода в растворе. Увеличение активности ионов водорода равносильно снижению рН раствора сопровождается увеличением скорости коррозии. Растворы с высоким содержанием рН (щелочные среды) растворяют металлы, гидраты окислов которых амфотерны (алюминий, цинк, свинец, олово и др.). Железо относится к металлам, которые растворяются в щелочах только при высоких концентрациях гидроксил-иона.
5.6.2.4 Коррозия основных конструкционных металлов и сплавов. Железо и его сплавы.  Железо может корродировать и с кислородной, и с водородной деполяризацией. В нейтральных растворах коррозия железа протекает преимущественно с кислородной деполяризацией. Образующиеся при этом продукты (катионы
Железо может корродировать и с кислородной, и с водородной деполяризацией. В нейтральных растворах коррозия железа протекает преимущественно с кислородной деполяризацией. Образующиеся при этом продукты (катионы  и анионы
и анионы  ) взаимодействуют с образованием гидроксида железа (II) белого цвета, который окисляется до гидроксида железа (III) бурого цвета:
) взаимодействуют с образованием гидроксида железа (II) белого цвета, который окисляется до гидроксида железа (III) бурого цвета:
 .
.
При дальнейшем превращении этих продуктов образуется ржавчина, состав которой можно выразить уравнением  .
.
Основные факторы, обусловливающие коррозию железа и его сплавов.
Влияние кислорода и анионов. С увеличением содержания кислорода в коррозионной среде скорость коррозии железа вначале возрастает, достигая максимального значения (для водных растворов) при содержании кислорода 16 см3/дм3, затем уменьшается. Последнее обусловлено пассивацией железа за счет образования оксидной пленки. В нейтральных растворах хлоридов или сульфатов увеличение концентрации соли приводит к экстремальному изменению скорости коррозии. При этом для раствора  максимум скорости соответствует 3%-й концентрации раствора. При меньшем содержании
максимум скорости соответствует 3%-й концентрации раствора. При меньшем содержании  анионы
анионы  активируют и облегчают анодный процесс, при большем содержании уменьшается растворимость кислорода.
активируют и облегчают анодный процесс, при большем содержании уменьшается растворимость кислорода.
В присутствии анионов  и других скорость коррозии железа понижается и может быть сведена к нулю за счет анодного процесса.
и других скорость коррозии железа понижается и может быть сведена к нулю за счет анодного процесса.

|
| Рисунок 5.5 – Зависимость скорости коррозии железа в водном растворе от кислотности среды |
Влияние рН раствора. Скорость коррозии железа в кислых средах уменьшается с повышением рН до четырех, а затем остается постоянной до рН = 9,5 (рисунок 5.5). Это обусловлено образованием  насыщенный раствор которого имеет рН = 9,5. При большем рН железо пассивируется и скорость коррозии уменьшается. В концентрированных щелочах при повышенной температуре скорость коррозии может снова увеличиться за счет образования гипоферрита
насыщенный раствор которого имеет рН = 9,5. При большем рН железо пассивируется и скорость коррозии уменьшается. В концентрированных щелочах при повышенной температуре скорость коррозии может снова увеличиться за счет образования гипоферрита  при этом выделяется водород.
при этом выделяется водород.
 В неокислительных кислотах (
В неокислительных кислотах (  разб.) коррозия железа происходит с водородной деполяризацией. При повышении концентрации
разб.) коррозия железа происходит с водородной деполяризацией. При повышении концентрации  скорость коррозии увеличивается, достигая максимума в 30%-х и 50%-х растворах соответственно. При более высокой концентрации кислот железо пассивируется и коррозия не происходит. В растворе
скорость коррозии увеличивается, достигая максимума в 30%-х и 50%-х растворах соответственно. При более высокой концентрации кислот железо пассивируется и коррозия не происходит. В растворе  скорость коррозии железа ниже, чем в
скорость коррозии железа ниже, чем в  такой же концентрации.
такой же концентрации.
Атмосферная коррозия железа протекает с кислородной деполяризацией. При этом под тонкой пленкой влаги коррозия идет более интенсивно, чем при полном погружении материала в электролит. Критическая влажность для чистого железа в чистом воздухе составляет примерно 100 %, при содержании 0,1 % 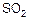 – 70 %, а при наличии на поверхности ржавчины – 55–65 %.
– 70 %, а при наличии на поверхности ржавчины – 55–65 %.
Коррозии железа способствует загрязнение воздуха 
 , а также частичками угля. Образовавшиеся продукты коррозии оказывают защитное действие, поэтому скорость атмосферной коррозии со временем снижается. Например, в условиях промышленной атмосферы скорость атмосферной коррозии железа за 9 лет снижается в 20 раз. Следует отметить, что это не относится к прокатной окалине, которая всегда усиливает коррозию.
, а также частичками угля. Образовавшиеся продукты коррозии оказывают защитное действие, поэтому скорость атмосферной коррозии со временем снижается. Например, в условиях промышленной атмосферы скорость атмосферной коррозии железа за 9 лет снижается в 20 раз. Следует отметить, что это не относится к прокатной окалине, которая всегда усиливает коррозию.

|
| Рисунок 5.6 – Зависимость скорости коррозии стали от температуры отпуска |
Коррозия низколегированных сталей. Сталь – осно-вной конструкционный материал. Компонентом, во многом определяющим механические свойства сталей, является углерод, в низколегированных сталях наибольшее его количество содержит цементит. Электродный потенциал цементита обычно более положителен, чем остальных структурных составляющих стали, поэтому он работает в качестве катода. При коррозии в атмосферных условиях цементит и другие катодные составляющие мало влияют на скорость коррозии.
В кислых средах при протекании коррозии с водородной деполяризацией влияние цементита весьма велико. В общем повышение содержания углерода в стали увеличивает скорость ее коррозии в кислотах. Скорость коррозии стали возрастает также с увеличением содержания карбидов, которое зависит от температуры отпуска: с повышением температуры оно сначала возрастает, а затем уменьшается. Этим же обусловлена аналогичная зависимость скорости коррозии стали от температуры отпуска (рисунок 5.6).
Изменение содержания основных легирующих элементов в низколегированных сталях не оказывает существенного влияния на скорость коррозии. Присутствие серы увеличивает скорость атмосферной коррозии и коррозии в кислотах. Медь (0,3–0,8 %) заметно повышает устойчивость низколегированных сталей к атмосферной коррозии.
Высокохромистые стали. Сталь с содержанием хрома не менее 12 % переходит в пассивное состояние. При этом скорость коррозии снижается. В кислотах-неокислителях (  разб.) с увеличением содержания хрома скорость коррозии стали растет, а в кислотах-окислителях (
разб.) с увеличением содержания хрома скорость коррозии стали растет, а в кислотах-окислителях (  конц.) снижается. Коррозионная стойкость этих сталей зависит от вида термической обработки. После закалки они обладают высокой коррозионной стойкостью, которая после отпуска уменьшается вследствие выпадения карбидов хрома. Наиболее сильно коррозионная стойкость снижается после отжига таких сталей, поскольку при этом карбиды хрома целиком выпадают из твердого раствора.
конц.) снижается. Коррозионная стойкость этих сталей зависит от вида термической обработки. После закалки они обладают высокой коррозионной стойкостью, которая после отпуска уменьшается вследствие выпадения карбидов хрома. Наиболее сильно коррозионная стойкость снижается после отжига таких сталей, поскольку при этом карбиды хрома целиком выпадают из твердого раствора.
Хромоникелевые аустенитные стали. Введение никеля в хромистые стали расширяет аустенитную область и улучшает их механические свойства. Коррозионная стойкость таких сталей обусловлена в основном хромом. Никель несколько увеличивает их стойкость в кислотах-неокислителях. Аустенитные стали неустойчивы в кипящей  (из-за перепассивации), корродируют в соляной, разбавленной серной, ледяной уксусной и в кипящих щавелевой и муравьиной кислотах. В определенных условиях они склонны к локальной коррозии и коррозионному растрескиванию. Так, склонность к межкристаллитной коррозии такие стали обнаруживают после закалки с температуры 900–1100 °С в растворах
(из-за перепассивации), корродируют в соляной, разбавленной серной, ледяной уксусной и в кипящих щавелевой и муравьиной кислотах. В определенных условиях они склонны к локальной коррозии и коррозионному растрескиванию. Так, склонность к межкристаллитной коррозии такие стали обнаруживают после закалки с температуры 900–1100 °С в растворах  и других кислот.
и других кислот.
Медь и ее сплавы.Медь может корродировать только с кислородной деполяризацией и переходит в раствор в виде  . При взаимодействии
. При взаимодействии  и
и  образуется труднорастворимый гидроксид
образуется труднорастворимый гидроксид  В присутствии
В присутствии  образуется
образуется  углекислого газа –
углекислого газа –  сернистого газа –
сернистого газа –  . В воде, нейтральных растворах и в атмосферных условиях медь обладает высокой коррозионной стойкостью за счет образования защитных пленок из продуктов коррозии
. В воде, нейтральных растворах и в атмосферных условиях медь обладает высокой коррозионной стойкостью за счет образования защитных пленок из продуктов коррозии 
 . В присутствии сернистого газа образуется пленка
. В присутствии сернистого газа образуется пленка  , не обладающая защитными свойствами, поэтому коррозия меди усиливается.
, не обладающая защитными свойствами, поэтому коррозия меди усиливается.
Медь устойчива в кислотах-неокислителях и легко растворяется в кислотах-окислителях. Сплавы меди могут обладать как большей коррозионной стойкостью (оловянистые бронзы, алюминиевые бронзы), так и меньшей (латунь). Латуни подвержены избирательной коррозии при содержании цинка более 15 % и коррозионному растрескиванию. Растрескивание деформированных латуней наблюдается в аммиаке, оксиде серы (IV), аммонийных солях.
Алюминий и его сплавы.На воздухе алюминий покрывается пленкой  толщиной 5–20 нм. Алюминий может корродировать и с кислородной, и с водородной деполяризацией. Продукты коррозии взаимодействуют с
толщиной 5–20 нм. Алюминий может корродировать и с кислородной, и с водородной деполяризацией. Продукты коррозии взаимодействуют с  , образуя при рН > 4 труднорастворимый
, образуя при рН > 4 труднорастворимый  превращающийся затем в
превращающийся затем в  .
.
 Оксидная и гидроксидная пленки обладают хорошей защитной способностью, поэтому алюминий устойчив в нейтральных растворах электролитов, не содержащих активаторов (
Оксидная и гидроксидная пленки обладают хорошей защитной способностью, поэтому алюминий устойчив в нейтральных растворах электролитов, не содержащих активаторов (  ), в атмосферных условиях (даже в присутствии
), в атмосферных условиях (даже в присутствии 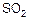 ). Скорость коррозии алюминия возрастает как при уменьшении, так и при увеличении рН, что связано с амфотерными свойствами оксида и гидроксида алюминия.
). Скорость коррозии алюминия возрастает как при уменьшении, так и при увеличении рН, что связано с амфотерными свойствами оксида и гидроксида алюминия.
Скорость коррозии алюминия в нейтральных и кислых средах увеличивается в присутствии железа, меди, серы.
Рассмотрим сплавы алюминия.
Дуралюмин(сплав  ) приобретает высокие механические свойства только после старения. При естественном старении коррозионная стойкость дуралюмина не снижается. При искусственном старении интерметаллиды
) приобретает высокие механические свойства только после старения. При естественном старении коррозионная стойкость дуралюмина не снижается. При искусственном старении интерметаллиды  выпадающие по границам зерен, снижают коррозионную стойкость алюминия. Коррозионная стойкость сплава Al–Zn (B95) ниже, чем дуралюмина, который корродирует даже после естественного старения, а сплава
выпадающие по границам зерен, снижают коррозионную стойкость алюминия. Коррозионная стойкость сплава Al–Zn (B95) ниже, чем дуралюмина, который корродирует даже после естественного старения, а сплава  – выше.
– выше.
Магний имеет сильно отрицательный стандартный электродный потенциал, поэтому легко корродирует с водородной и кислородной деполяризацией. Он корродирует практически в любых кислотах, кроме плавиковой  (образуется защитная пленка
(образуется защитная пленка  ), а в нейтральных растворах корродирует с водородной деполяризацией. Наиболее легко магний корродирует в
), а в нейтральных растворах корродирует с водородной деполяризацией. Наиболее легко магний корродирует в  растворяющем пленку гидроксида
растворяющем пленку гидроксида 
Примеси никеля, железа, меди увеличивают скорость коррозии магния в нейтральной среде. Коррозию во влажной среде усиливают хлориды.
Коррозионная стойкость сплавов магния находится на уровне стойкости чистого магния или превышает его (сплавы  ).
).
Никель по сравнению с железом больше склонен к пассивации. В нейтральных растворах никель корродирует с кислородной деполяризацией, в растворах кислот-неокислителей слабо корродирует с водородной деполяризацией. Он малоустойчив в азотной кислоте. Атмосферная коррозия зависит от наличия механических напряжений. Устойчив в сельской и морской атмосфере. В индустриальной атмосфере, содержащей  никель быстро тускнеет и заметно корродирует.
никель быстро тускнеет и заметно корродирует.
Титанлегко пассивируется и хорошо сохраняет пассивное состояние даже в растворах, содержащих активаторы (анионы  ). Этим объясняется его высокая коррозионная стойкость в морской воде,
). Этим объясняется его высокая коррозионная стойкость в морской воде,  и
и  Однако приложение растягивающих усилий может значительно увеличить скорость коррозии титана в этих средах. Сплавы
Однако приложение растягивающих усилий может значительно увеличить скорость коррозии титана в этих средах. Сплавы  склонны к коррозионному растрескиванию.
склонны к коррозионному растрескиванию.
Цинк и кадмий могут корродировать как с водородной, так и с кислородной деполяризацией. Железо, медь и другие примеси с низким перенапряжением водорода ускоряют коррозию цинка в кислотах. Чистый цинк в кислотах-неокислителях корродирует слабо.
В нейтральных растворах цинк и кадмий корродируют с кислородной деполяризацией. При этом на поверхности данных металлов образуются защитные пленки гидроксидов. Гидроксид цинка амфотерен и растворяется в кислотах и щелочах, поэтому при повышении рН скорость коррозии цинка сначала понижается, а потом снова повышается. Для гидроксида кадмия характерны только основные свойства, поэтому при повышении рН скорость его коррозии уменьшается. В нейтральной среде скорость коррозии цинка зависит от температуры. При температуре менее 50 и более 95 °С на поверхности цинка образуется плотная защитная пленка. В интервале температур 50–95 °С образуется зернистая пленка с низкими защитными качествами. В атмосфере коррозия цинка усиливается в присутствии  хлоридов, при высокой влажности и температуре. В этих условиях кадмий более стоек, зато цинк более устойчив в промышленной атмосфере.
хлоридов, при высокой влажности и температуре. В этих условиях кадмий более стоек, зато цинк более устойчив в промышленной атмосфере.
5.6.2.5 Атмосферная коррозия.Большинство металлоконструкций эксплуатируется в атмосферных условиях, поэтому атмосферная коррозия – наиболее распространенный вид коррозии.
По агрессивности атмосферы разделяют на следующие основные типы: морскую, промышленную, тропическую, арктическую, городскую и сельскую.
Коррозионные повреждения вызывают конденсация паров влаги из воздуха и атмосферные осадки. Конструкции зданий подвергаются увлажнению даже в тех случаях, когда они находятся в относительно сухой атмосфере. Выпадение конденсата на поверхности конструкций обусловлено прежде всего суточными колебаниями температуры окружающего воздуха. Содержание водяных паров в воздухе при понижении температуры достигает полного насыщения, что соответствует точке росы. При незначительном охлаждении воздуха ниже точки росы пары начинают конденсироваться на поверхности конструкции. Расчеты показывают, что при относительной влажности воздуха, равной 70 %, для выпадения конденсата температура конструкции должна быть ниже температуры воздуха на 6 °С. В пленках электролита, образовавшихся из конденсата, много минеральных веществ. Туманы и роса, вызывающие увлажнение металлических конструкций зданий, обычно имеют кислую реакцию (рН = =3 ... 4) в результате растворения в них хлористых, сернистых и других химически активных примесей. В определенных условиях влага на поверхности конструкции может конденсироваться из относительно сухой атмосферы. Это обусловлено явлениями капиллярной конденсации, когда поверхность загрязнена продуктами коррозии или другими веществами. Чистые и гладкие поверхности увлажняются только при адсорбции водяного пара влагой из нескольких молекулярных слоев. При заданном температурном перепаде и относительной влажности в зависимости от времени конденсации на поверхности конструкции может выпадать неодинаковое количество конденсата. При непродолжительной конденсации на поверхности появляются капельки влаги. Аналогичная картина наблюдается при длительной конденсации из относительно сухой воздушной среды.
На процесс коррозии металлических конструкций влияет не только количество сконденсированной влаги, но и характер ее распределения по поверхности. Отличительной чертой коррозионных повреждений, вызванных конденсационной влагой, по сравнению с другими видами коррозии, являются неравномерное распределение мест повреждений и язвенный характер.
При увлажнении поверхности металла образуются либо фазовые, либо адсорбционные пленки влаги. Фазовые пленки формируются при дожде, обливании или при влажности ≈100 %, адсорбционная пленка – вследствие конденсации влаги при влажности 60–70 %.
Атмосферная коррозия протекает преимущественно с кислородной деполяризацией. Ее принято классифицировать по толщине пленки влаги, образовавшейся на поверхности металла (рисунок 5.7).

|
| Рисунок 5.7 – Зависимость скорости коррозии от толщины пленки адсорбированной влаги |
В области сухой коррозии (I)конденсации влаги на поверхности практически нет; коррозия протекает по химическому механизму. В области влажной коррозии (II) на поверхности металла присутствует адсорбционная пленка влаги; коррозия протекает с анодным торможением. Через тонкую пленку кислород проникает свободно, поэтому катодный процесс не затруднен. Анодный процесс тормозят продукты коррозии. В области мокрой коррозии (III) на поверхности металла присутствует фазовая пленка влаги. Здесь имеет место катодное торможение, так как затруднен доступ кислорода к поверхности. Область IV является областью полного погружения.
Значительно влияет на скорость коррозии толщина пленки влаги. Наибольшие местные разрушения конструкций из металла отмечаются при конденсации влаги 2–3 г/дм2. При больших или меньших количествах влаги интенсивность коррозионного разрушения снижается. В толстых слоях электролита скорость коррозии обусловлена торможением катодных процессов из-за недостаточного доступа кислорода, в тонких слоях – вследствие затруднения анодного растворения металла. Следует иметь в виду, что высокие скорости конденсации или длительная ежесуточная конденсация влаги вызывают слияние отдельных мелких капель в более крупные, а затем – образование сплошной пленки. Однако не всегда интенсивность коррозии однозначно зависит от толщины пленки. Растворение в электролите сернистых газов, присутствующих в атмосфере, или хлоридов значительно увеличивает скорость коррозии. Установлено, что наличие в атмосфере 0,1 % диоксида серы 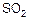 ускоряет процесс конденсационной коррозии в шесть раз по сравнению с коррозией в чистой атмосфере. При периодическом увлажнении конструкций атмосферным конденсатом, насыщенным парами раствора хлорида натрия, скорость коррозии больше в девять раз по сравнению с интенсивностью коррозионного разрушения в чистой атмосфере. При этом коррозионный процесс активизируется попеременным высушиванием и увлажнением конструкций во время эксплуатации.
ускоряет процесс конденсационной коррозии в шесть раз по сравнению с коррозией в чистой атмосфере. При периодическом увлажнении конструкций атмосферным конденсатом, насыщенным парами раствора хлорида натрия, скорость коррозии больше в девять раз по сравнению с интенсивностью коррозионного разрушения в чистой атмосфере. При этом коррозионный процесс активизируется попеременным высушиванием и увлажнением конструкций во время эксплуатации.
Относительная влажность, соответствующая началу адсорбционной конденсации влаги, называется критической влажностью. Она зависит от природы металла, его состояния и от степени загрязнения воздуха.
В Беларуси наблюдается значительная продолжительность периода увлажнения (более 3000 ч/год), что способствует протеканию атмо-сферной коррозии. Скорость атмосферной коррозии зависит также от температуры, наличия загрязнений, поэтому она неодинакова в различных регионах.
Как уже отмечалось, в Беларуси наблюдается наибольшая продолжительность увлажнения поверхности металла в течение года, поэтому республика относится к числу наиболее опасных в коррозионном отношении стран СНГ. Глубина коррозии железа здесь достигает в сельских районах 43 мкм в год по сравнению с 9 мкм /год в Средней Азии и 13 мкм в Сибири. Максимум коррозионных потерь обычно приходится на осенний период.
Атмосферная коррозия ускоряется в присутствии некоторых газов ( 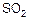 ), частичек солей (
), частичек солей (  ). Однако это ускорение меньше, чем вызываемое климатическими факторами.
). Однако это ускорение меньше, чем вызываемое климатическими факторами.
Стойкость металлов к атмосферной коррозии зависит от их природы и состояния поверхности. Средние значения глубинного показателя скорости коррозии для различных металлов изменяются от 4 до 200 мкм в год (для свинца – 4 мкм, алюминия – 8, олова – 12, меди – 12, никеля – 32, цинка – 50, железа – 200 мкм в год).
Ускорению коррозии способствуют шероховатость поверхности, наличие пыли и других загрязнений, факторы, облегчающие конденсацию влаги.
5.6.2.6 Подземная коррозия металлических конструкций. В грунтах находится большое количество металлоконструкций (трубопроводы, силовые кабели и кабели связи, опоры строительных конструкций и линий электропередачи, емкости и другое оборудование). Все они подвержены воздействию подземной коррозии. Ее определяющие факторы можно разделить на внутренние, зависящие от вида металла, его однородности и других параметров, и внешние, зависящие от характеристик воды и грунтов, окружающих сооружение: пористости, влажности, кислотности или щелочности, электропроводности, температуры и др.
Подземная коррозия вызывается неоднородностью окружающей среды и неравномерным доступом кислорода к различным участкам подземных конструкций. В большинстве случаев такая коррозия приводит к разрушению отдельных участков конструкции в виде глубоких язв. Причинами, обусловливающими неравномерный доступ кислорода к сравнительно малым участкам, могут быть разная плотность грунтов, нарушение на небольших участках сплошности изоляционного покрытия, неодинаковая влажность грунтов.
Для подземной коррозии характерно локальное разрушение металлов в виде питтинга, язв и раковин. Эмпирическое уравнение, связывающее максимальную глубину раковины (Р) с временем эксплуатации трубопровода (  ), имеет следующий вид:
), имеет следующий вид:
 ,
,
где К – коэффициент пропорциональности;
n – константа, зависящая от степени аэрации почвы: в хорошо аэрируемых грунтах n = 0,1 ¼ 0,2 (песок, суглинок), в слабо аэрируемых (торф, тяжелые глины) n = 0,6 ¼ 0,7.
На развитие подземной коррозии оказывают влияние различные факторы.
Структура и состав грунтов