Типы окислительно-восстановительных реакций
Все химические реакции можно разделить на два типа.
К первому относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав молекул реагирующих веществ и продуктов реакции, например:
+1 +4 –2 +1 –1 +1 –1 +1 –2 +4 –2
1) Na2CO3 + 2HCl =2NaCl + H2O + CO2;
+2 +1 +4 –2 +2 +4 –2 +1 –2 +4 –2
2) Ca(HCO3)2 = CaCO3 + H2O + CO2;
+2 –2 +1 –2 +2 –2 +1
3) BaO + H2O = Ba(OH)2.
Такие реакции называются ионообменными.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ, например:
+1 +5 –2 +1 –1 0
2KClO3 = 2KCl + O2
+1 –1 0 0 +1 –1
2KBr + Cl2 = Br2 + 2KCl
Здесь в первой реакции атомы хлора и кислорода, а во второй — атомы брома и хлора изменяют степень окисления. Такие реакции называются окислительно-восстановительными.
Все окислительно-восстановительные процессы могут быть разделены на три типа: межмолекулярные, дисмутационные и внутримолекулярные.
Реакции межмолекулярного окисления-восстановления являются наиболее распространенными окислительно-восстановительными реакциями. Это такие реакции, в которых атомы окислителя и восстановителя находятся в разных молекулах. Например:
0 0 +4 –2
C + O2 → CO2;
0 +4– 2 +2 –2 0
Mg + CO2 → MgO + C;
+2 –2 0 0 +1 –2
СuO + H2 → Cu + H2O.
Реакцией окислительно-восстановительной дисмутации (или диспропорционирования) называется реакция, в которой из одного исходного вещества образуются два соединения, причем в одно из них входят атомы с более высокой, а в другое с более низкой степенью окисления по сравнению с первоначальной степенью окисления элемента. В уравнениях реакций диспропорционирования после составления электронных уравнений необходимо в первую очередь расставить коэффициенты в правую часть уравнения.
+1 +3 –2 +1 +5–l +2 –2 + 1 –1
НNО2 → НNO3 + NO + H2O.
Атомы азота в соединении НNО2 имеют промежуточную степень окисления (+3). Часть атомов азота со степенью окисления (+3) окисляется, приобретая более высокую степень окисления (+5). Другая часть атомов азота восстанавливается, переходя в состояние со степенью окисления (+2).
Внутримолекулярной реакцией окисления-восстановления называется реакция, приводящая к разложению вещества на более простые, при этом переход электронов происходит между двумя атомами, входящими в состав одной и той же молекулы вещества. Это могут быть как атомы разных элементов, так и одного элемента, находящегося в различных степенях окисления:
NH4NO3 → N2O + H2O.
В соединении NH4NO3 атомы азота со степенью окисления (–3), входящие в состав аммонийной группы — сильные восстановители, а атомы азота со степенью окисления (+5) — сильные окислители.
1.7. Нахождение коэффициентов в уравнениях
окислительно-восстановительных реакций
Правильно составленное уравнение реакции является выражением закона сохранения массы веществ, поэтому необходимо следить за тем, чтобы число одинаковых атомов в исходных веществах и продуктах реакции было равным. Для нахождения коэффициентов в уравнениях окислительно-восстановительных реакций могут быть применены два метода: метод электронного баланса и метод электронно-ионного баланса. В данном учебном пособии ограничимся более простым методом электронного баланса.
Уравнивание окислительно-восстановительных уравнений по методу электронного баланса осуществляется в несколько стадий:
1. Записывают формулы веществ, вступающих в реакцию, а после стрелки — формулы продуктов реакции. Например:
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O.
2. Определяют степени окисления атомов элементов до и после реакции, их величины проставляют над символами соответствующих атомов.
+2 –2 +1+5 –2 0 +2 +5–2 +2 –2 +1 –2
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O.
3) Составляют электронные уравнения для процессов окисления и восстановления (полуреакции), число электронов в каждой из полуреакций является коэффициентом, на который умножают другую полуреакцию:
восстановитель S–2 – 2ē → S0 |(3) окисление
окислитель N+5+ 3ē → N+2 |(2) восстановление.
В данном случае найденные множители не имеют общих делителей, но если их можно сократить, это следует сделать. Необходимо учитывать, что полуреакцию записывают для такого количества атомов или ионов, сколько их входит в состав молекулы исходного вещества или в состав молекулы продукта реакции.
4. В уравнении ставят коэффициенты перед молекулами, содержащими атом-окислитель и атом-восстановитель. Учитывать следует именно те атомы, которые действительно принимают участие в записанной полуреакции, а не переходят в продукт реакции без изменения степени окисления.
Например, в рассматриваемом уравнении, азот, приобретая электроны, является окислителем. Но, кроме участия в окислительно-восстановительном процессе, азотная кислота связывает ионы свинца в виде нитрата; при этом степень окисления азота N+5 в составе кислотных остатков не изменяется. Значит, в данном случае коэффициент в правой части, относящийся к полученному в полуреакции восстановления азоту N+2, ставится именно перед молекулой оксида азота, а не нитрата свинца, и уже потом число атомов азота в левой части находят как сумму всех атомов азота в правой части. В других случаях, наоборот, по левой части уравнивается правая.
5. Последовательно находят коэффициенты перед всеми остальными молекулами, каждый раз убеждаясь, что найденное число однозначно определяется из уже проставленных коэффициентов:
3PbS + 8HNO3 → 3S + 3Pb(NO3)2 + 2NO + 4H2O.
6. Убеждаются в правильности расстановки коэффициентов, подсчитывая и сравнивая число атомов кислорода в левой и в правой частях уравнения.
Встречаются реакции, в которых число частиц, изменяющих свою степень окисления, больше двух. Тогда определяют общее число электронов, отданных восстановителями, и общее число электронов, принятых окислителями, а в остальном придерживаются вышеизложенных правил. Например, в реакции:
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO
участвуют два восстановителя:
2As+3– 4ē → 2AS+5;
3S–2 – 24ē → 3S+6.
Здесь также необходимо записывать полуреакцию для такого количества атомов или ионов, сколько их входит в состав молекул исходного вещества или в состав молекул продуктов реакции. Именно поэтому в полуреакциях берется сразу два атома мышьяка и три атома серы.
В итоге:
 Восстановители:
Восстановители:
2As+3 + 3S–2 – 28ē → 2As+5 + 3S+6 (3ē) окисление.
Окислитель:
N+5 + 3ē → N+2 (28ē) восстановление.
1.8. Направление и полнота протекания
окислительно-восстановительных реакций
Как следует из вышеизложенного материала, каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления, и возможность прохождения каждой из этих полуреакций определяется тем, что некоторый атом или ион может существовать в двух формах: окисленной и восстановленной. Например, Fe+2 является восстановленной формой по отношению к Fe+3 и, в то же время, окисленной по отношению к металлическому железу Fe. Говорят, что образуются окислительно-восстановительные системы или окислительно-восстановительные пары Fe+3/Fe+2 и Fe+2/Fe, в которых, соответственно, протекают обратимые процессы:
Fe+3 + ē ←→ Fe+2;
Fe+2 + 2ē ←→ Fe.
Реакцию, происходящую в системе, принято записывать как процесс восстановления, независимо от того, в какую сторону в действительности протекает процесс.
Переход из одной формы в другую вызывают пространственное разделение электрических зарядов и, следовательно, вызывает появление разности потенциалов. Разность потенциалов, образующуюся при протекании записанного процесса восстановления, обозначают E и называют окислительно-восстановительным потенциалом. Используют также термин электродный потенциал, поскольку при протекании реакции в гальваническом элементе или в ходе электролиза (см. далее работы «Гальванический элемент» и «Электролиз»), каждая полуреакция протекает на соответствующем электроде, т.е. может быть названа электродным процессом.
Величина окислительно-восстановительного потенциала характеризует окислительно-восстановительную способность данной пары (системы). Говоря о величине E системы, всегда указывают, в результате взаимного перехода каких двух форм он возникает. В общем случае окисленная форма обозначается символом Ох (oxidated), а восстановленная — Red (reduced — см. пояснение в разделе 1.2.):
Ох + nē ←→ Red.
В индексе при обозначении электродного потенциала формула окисленной формы указывается в числителе, а восстановленной— в знаменателе:
ЕOx/Red.
Например, для окислительно-восстановительной системы двухвалентное железо — трехвалентное железо:
ЕFe3+/Fe2+.
Значение окислительно-восстановительного потенциала, измеренное в стандартных условиях (25 °C, т.е 298 К, и давление 1 атм) при условии, что концентрации обеих форм равны 1 моль/л, называется стандартным окислительно-восстановительным потенциалом данной системы и обозначается Е0Ox/Red.Значения стандартных потенциалов для различных окислительно-восстановительных систем приведены в табл. 1.
В условиях, отличных от стандартных, окислительно-восстановительный потенциал системы вычисляется по формуле Нернста:
ЕOx/Red = Е0Ox/Red+ 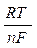 ln
ln 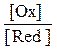 ,
,
где Т — абсолютная температура (273 + t), К; F — число Фарадея, n — число электронов, участвующих в реакции окисления-восстановления; [Ох] — концентрация окисленной формы; [Red] — концентрация восстановленной формы; R — универсальная газовая постоянная (8,314 Дж/моль град).
Таким образом, физический смысл величины Е0 — это окислительно-восстановительный потенциал системы при стандартных условиях и при концентрациях всех участвующих в процессе веществ, равных единице; тогда:
ЕOx/Red= Е0Ox/Red.
Если в формулу Нернста подставить значения физико-химических констант R и F и перейти от натурального логарифма к десятичному
(lna =2,303lga), то для температуры 25°С (298 К) получим выражение:
ЕOx/Red = Е0Ox/Red+ 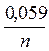 lg
lg 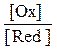 .
.
Поскольку окислительно-восстановительный потенциал служит мерой окислительной (и восстановительной) способности окислительно-восстановительной системы, то, сравнивая величины E двух систем, можно определить направление протекания окислительно-восстановительной реакции. Пользуются правилом, что та окислительно-восстановительная пара, потенциал которой выше, выступает в роли системы-окислителя. При этом получается, что условием протекания реакции является положительное значение ЭДС образующегося при реакции гальванического элемента:
ЭДС = DE = Eокислителя – Eвосстановителя .
1 Таблица
Стандартные электродные потенциалы Е0 в водных растворах при 25 °C
| Элемент | Электродный процесс | Е0, В |
| Ag | Ag+ + ē → Ag0 | +0,80 |
| Al | Al3+ + 3ē → Al0 | –1,66 |
| Au | Au3+ + 3ē → Au0 Au+ + ē → Au0 | +1,50 +1,69 |
| Ba | Ba2+ + 2ē → Ba0 | –2,90 |
| Bi | Bi3+ + 3ē → Bi0 | +0,21 |
| Br | Br2 + 2ē → 2Br– | +1,07 |
| Ca | Ca2+ + 2ē → Ca0 | –2,87 |
| Cd | Cd2+ + 2ē → Cd0 | –0,40 |
| Cl | Cl2 + 2ē → 2Cl– | +1,36 |
| Co | Co2+ + 2ē → Co0 Co3+ + ē → Co2+ | –0,28 +1,81 |
| Cr | Cr3+ + 3ē → Cr0 | –0,74 |
| Cu | Cu2+ + ē → Cu+ Cu2+ + 2ē → Cu0 Cu+ + ē → Cu0 | +0,15 +0,34 +0,52 |
| F | F2 + 2ē → 2F- | 2,87 |
| Fe | Fe2+ + 2ē → Fe0 Fe3+ + 3ē → Fe0 Fe3+ + ē → Fe2+ | –0,44 –0,04 +0,77 |
| H | 2H+ + 2ē → H2 | 0,00 |
| Hg | Hg22+ + 2ē → 2Hg0 Hg2+ + 2ē → Hg0 2Hg2+ + 2ē → Hg22+ | +0,79 +0,85 +0,92 |
| I | I2 + 2ē → 2I | +0,54 |
| K | K+ + ē → K0 | –2,92 |
| Li | Li+ + ē → Li0 | –3,04 |
| Mg | Mg2+ + 2ē → Mg0 | –2,36 |
| Na | Na+ + ē → Na0 | –2,71 |
| Ni | Ni2+ + 2ē → Ni0 | –0,25 |
| O | O2 + 2H2O + 4ē → 4OH– O2 + 4H+ + 4ē → 2H2O | +0,40 +1,23 |
| Pb | Pb2+ + 2ē → Pb0 | –0,13 |
| Pt | Pt2+ + 2ē → Pt0 | +1,19 |
| S | S2O82– + 2ē → 2SO42– | +2,01 |
| Sn | Sn2+ + 2ē → Sn0 | –0,14 |
| Zn | Zn2+ + 2ē → Zn0 | –0,76 |
Рассмотрим эти положения на примере следующих задач.
Пример 1. В какую сторону пойдет реакция с участием диоксида свинца (РbО2) и иодида калия (KI) в кислой среде, если концентрации веществ равны 1 моль/л?
Уравнение реакции:
2KI + РbО2 + 2H2SO4 ←→ I2 + K2SO4 + PbSO4 + 2H2O.
В реакции участвуют две системы, каждая из которых характеризуется своим окислительно-восстановительным потенциалом, равным в данном случае (поскольку С = 1) стандартному окислительно-восстановительному потенциалу (см. табл. 1):
Система 2I–/I2 I20 + 2ē → 2I Е02I–/I2= +0,53 B;
Система PbO2/Pb+2 Pb+4 +2ē → Pb2+ Е0PbO2/Pb+2= +1,68 B.
Для системы четырех- и двухвалентного свинца потенциал выше, чем для пары 2I–/I2, поэтому в данной реакции окислителем является система PbO2/Pb+2. Для свинца процесс будет протекать именно так, как записан в таблице, слева направо, как процесс восстановления. Система 2I–/I2с меньшим потенциалом будет выступать в роли восстановителя, электродный процесс для нее пойдет в обратную сторону, справа налево, как процесс окисления иодид-ионов. В итоге, электронный баланс для реакции:
окисление 2I – 2ē → I20 восстановитель;
восстановление Pb+4 +2ē → Pb+2 окислитель.
Итак, рассматриваемая в задаче реакция идет слева направо. Роль окислителя выполняет свинец со степенью окисления +4, т.е. входящий в состав молекулы РbO2.
Подтверждением возможности протекания реакции также является положительное значение разности окислительно-восстановительных потенциалов систем:
ЭДС = DE = 1,68 – 0,53 = 1,15 B.
Пример 2. Будет ли металлическое серебро растворяться в разбавленной серной кислоте?
Уравнение реакции:
Ag + H2SO4 (p-р) ←→ Ag2SO4 + H2.
Для ориентировочной оценки возможности протекания реакции можно воспользоваться значениями стандартных окислительно-восстановительных потенциалов участвующих в реакции систем.
Е0Ag+/Ag=+0,799 B; Е0H2/H+= 0,00 B.
Если предположить, что рассматриваемая реакция возможна, то в роли окислителя должен выступать ион H+. Но тогда
ЭДС = DE = 0 – 0,799 = – 0,799 B < 0.
Так как ЭДС имеет отрицательное значение, реакция идти не может, а значит, серебро в разбавленной серной кислоте растворяться не будет. К такому же выводу можно прийти без вычисления ЭДС из того соображения, что по соотношению величин Е0 серебро в реакции должно являться окислителем, а в предложенной к рассмотрению реакции ему отведена роль восстановителя, чего быть не должно.
Если возможно одновременное протекание двух реакций, например, если в процессе конкурируют два восстановителя или два окислителя, следует учитывать, что чем больше величина потенциала окислителя по сравнению с величиной потенциала восстановителя, тем более вероятна возможность протекания процесса. Другими словами, из всех возможных при данных условиях окислительно-восстановительных реакций пойдет та, для которой разность окислительно-восстановительных потенциалов наибольшая. В качестве примера рассмотрим задачу:
Пример 3.Определить, какой из металлов — барий или никель лучше взаимодействует с соляной кислотой.
Уравнения реакций:
Ва + 2HСl = ВаСl2 +H2;
Ni + 2HCl = NiCl2 + Н2.
Находим потенциалы пар:
Е0Ba2+/Ba= – 2,9 В; Е0Ni2+/Ni= – 0,2 В; Е0H2/H+= 0,00 B.
Вычислим ЭДС для первой и второй реакций:
ЭДС1 = DE = 0,00 – (– 2,9) = 2,9 В;
ЭДС2 = DE = 0,00 – (– 0,25) = 0,25 B.
ЭДС первой реакции значительно больше чем второй реакции. Следовательно, барий будет взаимодействовать с соляной кислотой более интенсивно, чем никель.
В некоторых случаях нужно знать не только направление окислительно-восстановительной реакции, но и полноту ее протекания. Так, например, в количественном анализе можно использовать только те реакции, которые протекают практически на 100%. Степень полноты протекания реакции определяется величиной константы равновесия К (см. материал работы «Химическое равновесие» в части 1 настоящего Практикума). Преимущественное протекание прямой реакции имеет место при К >> 1. Для реакций, которые представляются нам необратимыми, К составляет 1015…1020 и более.
Величина константы равновесия окислительно-восстановительной реакции может быть вычислена по значению ЭДС реакции. При этом следует учесть, что чем ближе состояние системы химических регентов к состоянию равновесия, тем менее интенсивно протекает реакция, а достижение состояния равновесия означает фактическое прекращение происходившей до того момента прямой реакции. Поэтому в состоянии равновесия электродвижущая сила становится равна нулю, т.е. DE = 0. В качестве примера рассмотрим следующую задачу:
Пример 4.Вычислить константу равновесия реакции:
Zn + CuSO4 = Cu + ZnSO4.
Сокращенное ионное уравнение реакции:
Zn0 + Cu2+ = Cu0 + Zn2+.
В реакции участвуют две системы, каждой из которых соответствует свое значение Е0 (см. табл. 1):
система Zn2+/Zn0 Zn2+ + 2ē → Zn0 Е0Zn2+/Zn0= +0,76 B;
система Сг2+.Сг0 Сг2+ +2ē → Сг0 Е0Сг2+.Сг0= +0,34 В.
Поскольку концентрации атомов металлов в куске твердого металла постоянны, то в формуле Нернста для каждой из систем под знаком логарифма остается только концентрация ионов в растворе, в данном случае концентрации окисленных форм [Ox]. Концентрации восстановленной формы [Red] каждой пары, т.е. металлических меди и цинка, будучи постоянными величинами, включаются в значение стандартных окислительно-восстановительных потенциалов. Таким образом:
ЕCu2+/Cu= Е0Cu2+/Cu+ 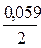 lg[Cu2+];
lg[Cu2+];
ЕZn2+/Zn= Е0Zn2+/Zn+ 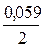 lg[Zn2+].
lg[Zn2+].
Также и в выражении для константы равновесия K отсутствуют концентрации металлических меди и цинка, и величина K выражается только через концентрации ионов цинка и меди в растворе:
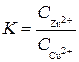 или
или 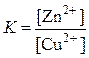 .
.
Подставляем значения стандартных потенциалов пар Zn2+/Zn0и Cu2+/Cu0в уравнения для расчета электродных потенциалов:
ЕCu2+/Cu.= +0,34 + 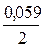 lg[Cu2+];
lg[Cu2+];
ЕZn2+/Zn.= –0,76 + 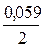 lg[Zn2+].
lg[Zn2+].
В состоянии равновесия:
Е0Cu2+/Cu= Е0Zn2+/Zn;
+0,34 + 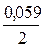 lg[Cu2+] = –0,76 +
lg[Cu2+] = –0,76 + 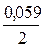 lg[Zn2+];
lg[Zn2+];
откуда +0,34 + 0,76 = 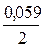 ln[Zn2+] –
ln[Zn2+] – 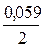 ln[Cu2+];
ln[Cu2+];
и затем: 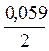 (lg[Zn2+] – lg[Cu2+]) = 1,01.
(lg[Zn2+] – lg[Cu2+]) = 1,01.
Тогда: 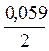 lg
lg 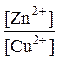 = 1,01;
= 1,01;
или 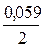 lgK = 1,01;
lgK = 1,01;
откуда находим:
lgK = 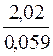 = 38.
= 38.
В итоге К = 1038.
Такое большое значение константы равновесия показывает, что цинк будет восстанавливать из раствора CuSO4 ионы меди до тех пор, пока в растворе концентрация ионов Cu+2 не станет в 1038 раз меньше, чем концентрация ионов Zn+2. Это значит, что рассматриваемая реакция практически идет до конца.
Из приведенного решения следует, что константа равновесия может быть найдена по значениям стандартных окислительно-восстановительных потенциалов по общей формуле (при условии, что в обеих парах число переходящих электронов n одинаково):
lgK = 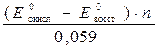
или K = 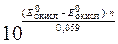 .
.
Таким образом, по величине ЭДС окислительно-восстановительной реакции можно через константу равновесия оценить, насколько полно протекает реакция.
В разделе общей химии «Химическая термодинамика» показывается, что константа равновесия и ЭДС реакции связаны через такую величину, как изменение изобарно-изотермического потенциала G реакции в стандартных условиях, которое выражается через упомянутые величины уравнениями:
ΔG0 = – RTlnK и ΔG0 = – nF(Е0окисл – Е0Восст).