Генетический контроль нейрогенеза. Краткие сведения
S.S.I. СОВРЕМЕННАЯ ЭПИГЕНЕТИЧЕСКАЯ КОНЦЕПЦИЯ
При анализе генетического контроля развития нервной системы (нейрогенеза) исследователи концентрируют внимание на общих закономерностях процесса, на особенностях формирования нервных клеток, а также на эффектах отдельных генов в этих процессах. Очевидно, четко разграничить указанные группы вопросов удается далеко не всегда.
Также как и в биологии развития в целом, ключевой вопрос в изучении нейрогенеза – определение того, как (и почему) экспрессия группы генов происходит в данный момент и в соответствующем участке ткани. Понятно, что эти процессы регулируются не только генетической программой, действующей в конкретной группе клеток, но и внешними по отношению к нейронам процессами.
В качестве примера такого взаимодействия можно рассмотреть процесс нейрогенеза при доминантной неврологической мутации мыши Lurcher, при которой у гетерозиготных особей в возрасте 2 недель гибнут все клетки Пуркинье мозжечка. Эта гибель – результат прямого действия мутантного аллеля гена Lc именно в этих клетках. В то же время показано, что последующая дегенерация 90% гранулярных клеток – это вторичный эффект, следствие отсутствия клеток Пуркинье. Клетки Пуркинье в норме способствуют формированию нормальных синаптических контактов гранулярных клеток, а отсутствие нормально развитых синапсов ведет к постепенной дегенерации гранулярных клеток.
Очевидно, что нейрогенез представляет собой не серию сменяющих друг друга стадий, а процесс, в ходе которого происходит непрерывное взаимодействие сигналов, поступающих из внешней среды, и информации, считывающейся с генома. В схематической форме, однако, нельзя обойтись без условного деления процесса развития на стадии. Это деление проводится и в соответствии с современной эпигенетической концепцией. Последовательные стадии развития можно представить в виде схем, в которые входит ряд компонентов. Успех каждой стадии развития обеспечивается наличием следующих компонентов: фенотипа – Р, продуктов экспрессии определенных генов </, и существованием некоторого набора внешних условий, которые могут варьировать в определенных пределах:
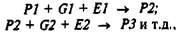
где PJ – это фенотип зиготы, Р2 – фенотип следующей стадии. При развитии нервной системы картина усложняется тем, что в категорию "внешних" условий попадают влияния, идущие от других, параллельно развивающихся глиальных и нервных клеток, которые по фенотипу и паттерну экспрессии генов не идентичны нейрону (или группе нейронов), интересующих нас в данный момент. Общий анализ показывает, что на нейрон действуют продукты экспрессии генов, которые можно условно разделить на 4 категории в зависимости от особенностей их экспрессии. Это гены, которые экспрессируются в дифференцирующихся нейронах, в нейронах других групп, в глиальных клетках и на уровне всего организма.
Схему хорошо иллюстрируют примеры развития нервной системы дрозофилы. Еще до появления первых эмбриональных закладок, во время образования трехслойного зародыша, на стадии нервного валика, т.е. в период, когда нервной системы еще нет, общий план ее строения уже начинает формироваться. Генетический контроль процесса в эти периоды трудно отделим от формирования общей схемы тела (подробнее см.: Корочкин, 1989, 1991, 1992).
8.5.2. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ОБЩЕЙ СХЕМЫ ТЕЛА
Дрозофила.В настоящее время достаточно много известно о генах, контролирующих формирование общей схемы тела животного. Группы генов, экспрессия которых обеспечивает формирование общего плана строения эмбриона, обнаруживают неслучайный уровень гомологии у всех изученных организмов. Большая часть этой информации получена на дрозофиле.
Еще до оплодотворения, т.е в ооците, начинается экспрессия генов, продукты которых несколько позже принимают участие в формировании различий между передним и задним полюсом оплодотворенного яйца дрозофилы. Это так называемые "материнские" гены. К ним относятся, например, ген caudal (определяет полярность ооцита), ген ЫсоШ (мутация по нему вызывает появление эмбрионов без головы и торакального ганглия), ген oskar (у мутантных эмбрионов нет брюшка).
Уже в самом эмбрионе проявляют свое действие гены других групп.
Больше всего информации получено по генам сегментации и по так называемым гомейозисным генам.
Гены сегментации. Мутации по ним нарушают метамерию, т.е. деление тела зародыша дрозофилы на сегменты, а также вызывают аномалии развития сегментов разных категорий. Могут происходить, например, потеря сегментов (ген gap), появление дефектных по структуре сегментов "через один" (ген pair rule), нарушение внутренней структуры полярности сегмента (engrailed). Совместное действие нормальных аллелей генов этих групп обеспечивает формирование сегментации тела. Мутации генов сегментации несовместимы с нормальным ходом эмбриогенеза и вызывают его остановку с последующей гибелью зародыша на разных стадиях.
Гомейозисные гены. Исторически первыми были описаны и изучены мутации по генам, которые вызывают заметные морфологические аномалии (уродства), но, тем не менее, совместимы с жизнью, т.е. не только не вызывают гибели зародыша, а даже не препятствуют метаморфозу и развитию имаго. Это так называемые го-мейозисные мутации, выражающиеся в формировании сегментов с "неправильными" органами. Наиболее известны среди них – мутации aristapedia и antennaepedia, когда вместо аристы или антенны на голове мухи формируется конечность.
Гомеобокс. Молекулярно-биологические исследования гомейо-зисных мутаций выявили в соответствующих участках ДНК короткую консервативную последовательность оснований, которая была названа гомеодоменом, или гомеобоксом (Нох) (подробнее см.: Дон-дуа, 1997). Гомеодомен кодирует небольшого размера белковую молекулу, которая может связываться с ДНК. Эти данные позволили предположить, что гомеобокс кодирует регуляторный белок, способный включать и выключать экспрессию генов в определенные моменты развития. Структурные особенности ДНК Яох-доменов подтверждают предположение, что продукты этих генов могут связываться с ДНК и регулировать транскрипцию.
Итак, действие генов ряда групп проявляется либо в оплодотворенном яйце, либо позднее, на разных стадиях формирования самого эмбриона.
Мышь.Если у дрозофилы экспрессия генов Нох связана преимущественно с формированием сегментов и/или их внутренней структуры, то у других организмов родственные последовательности Нох имеют более разнообразные функции. Такие же как у дрозофилы гомеобоксные последовательности выделены в геноме шпорцевой лягушки, мыши и человека. Наиболее интенсивная экспрессия этих генов у позвоночных происходит в ЦНС, в почках и в зародышевых клетках.
У мыши описано и клонировано не менее 20 локусов, содержащих гомеобокс (Яох-локусы). У ряда из них определена нуклеотид-ная последовательность. Большая часть Яох-содержащих генов локализуется у мыши на хромосомах 2, 6, 11 и 15.
Общность генетических механизмов развития схемы тела насекомых и позвоночных подтверждается многочисленными случаями гомологии в строении соответствующих генов дрозофилы и позвоночных, например гена полярности сегментов wingless и онкогена мыши int-1 или гена achaete-scute с онкогеном с-тус. Содержащие гомеобоксную последовательность гомейозисные гены групп engrailed и invected дрозофилы имеют гомологов в геноме мыши, которые экспрессируются в эмбриогенезе при формировании нейроэк-тодермы. Продукты их транскрипции проявляются в полосках ткани, располагающихся в складках нервного гребня.
Содержащие гомеобокс гены дрозофилы и мыши имеют сходство в пространственно-временной картине экспрессии в процессе развития. Как и у двукрылых, в эмбрионе млекопитающих эти гены экспрессируются вдоль ростро-каудальной оси эмбриона. Следует отметить, что исследование функций этих генов у млекопитающих, точнее, у одного из наиболее изученных генетических объектов – мыши – достаточно сложно, поскольку соответствующие мутации неизвестны, тогда как у дрозофилы, например, анализ подобных мутаций – один из ключевых методов исследования.
Вместо анализа мутаций при работе с мышью предложен ряд других методов изучения роли генома на ранних стадиях развития эмбриона. Один из наиболее продуктивных – введение в зародыш генетического материала, который представляет собой или измененный ген, имеющийся у хозяина, или делецию по определенному участку хромосомы (в этом случае используют специальные приемы, которые "заставляют" экспрессироваться новый ген). Можно также вводить ген, выделенный из генома другого вида. Примером последнего типа эксперимента служит работа американского ученого Р. Пальмитера (R. Palmiter) с сотрудниками. Они создали трансгенных мышей с геном, кодирующим гормон роста крысы под "транскрипционным контролем" так называемого промотора металлоте-неина, последовательности, которая экспрессируется практически во всех тканях. Несколько мышей, полученных таким способом, отличались очень крупными размерами (см. также: 8.6.3.4). Интеграцию в геном хозяина и экспрессию нужной ДНК последовательности обеспечивают технически сложные приемы, когда интересующий исследователя участок ДНК "сшивается" с последовательностями, экспрессия которых вызывается особыми физиологическими нагрузками.
С помощью трансгенных животных можно изучать фенотипичес-кие эффекты изменения "дозы" такого гена. Подобные эксперименты позволили установить, что во всех отделах ЦНС "трансгенного" эмбриона мыши в ростро-каудальном направлении имеются продукты транскрипции всех 7 генов блока Нох, введенного в геном.
Гомеобокс – это только один тип консервативной последовательности из всех других типов, выявленных у организмов разного уровня развития. Описаны и семейства генов, которые содержат белковые домены, выделенные в связи с исследованием разных функций. Гены сегментации дрозофилы Kruppel и hunchback имеют белковый домен, гомологичный транскрипционному фактору III, выделенному у шпорцевой лягушки, так называемому "белку с цинковыми пальцами". Ген Нох мыши, продукт которого также представляет собой белок с "цинковыми пальцами", локализуется в протосегментах заднего мозга эмбриона. Его продукты показывают экспрессию в порядке "через один сегмент". Такой метамерный рисунок в экспрессии гена – четкое молекулярно-генетическое доказательство существования сегментации мозга позвоночных.
Таким образом, дальнейшая дифференцировка мозга на отделы, по крайней мере частично, определяется событиями, которые причинно связаны с экспрессией генов "схемы тела". Сходство ряда участков генома, таких как гомеобоксные последовательности, у организмов, занимающих разное положение на систематической лестнице, показывает, что это еще один путь сравнительных исследований структуры и функции мозга.
8.5.3. ОБЩИЕ ПРОЦЕССЫ РАЗВИТИЯ И ЛОКАЛЬНЫЕ НАРУШЕНИЯ СТРУКТУРЫ ГЕНОМА
Белки, которые кодируются самим гомеобоксом или связанными с ним генетическими элементами, выполняют регуляторные функции. Это означает, что появление продуктов экспрессии таких генов, в свою очередь, вызывает экспрессию (или репрессию) целого ряда генов, кодирующих либо структурные белки, либо сигнальные молекулы, которые должны регулировать уже следующий каскад событий.
Даже беглое знакомство с подобными данными показывает, что в процессе развития выявляется некая иерархия управления, в которой гены каждого данного уровня передают инструкции "вниз" генам следующего уровня. Это в целом соответствует общей схеме эпигенетической концепции. Если в каком-то звене системы возникает мутация, то нормальный ход процесса развития нервной системы оказывается нарушенным. Очевидно, что чем "ближе" к началу нейрогенеза относится работа гена, претерпевшего мутацию, тем более сильный дефект вызывает такая мутация.
У человека и мыши, которые среди млекопитающих изучены генетически наиболее полно, описано много десятков мутаций, затрагивающих функцию нервной системы. Часть подобных случаев – это проявление обширного плейотропного эффекта генов, имеющих первичный дефект, изначально не связанный с нервной системой (см.: 8.2.2), другие же мутации влияют на формирование мозга более непосредственно. К их числу относятся так называемые неврологические мутации мыши, изучение которых дает информацию о роли тех или иных аллелей таких генов в нейрогенезе. У дрозофилы также выявлены подобные системы генов.
8.5.3.1. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ НЕЙРОЭМБРИОГЕНЕЗА У ДРОЗОФИЛЫ. У дрозофилы описаны "кластеры" (т.е. функционально объединенные группы) генов, совместная работа которых связана с дифференцировкой основных зародышевых закладок по "нервному", или "эпидермальному" пути дифференцировки. Это так называемые "нейрогенные" и "антинейрогенные" локусы. Нормальные аллели первых осуществляют в процессе развития влияния, благодаря которым часть эмбриональных клеток начинает дифференцироваться как эпидермальные. Мутации по этим генам вызывают аномалию развития, которая практически несовместима ни с дальнейшим процессом развития, ни с жизнью организма: у них происходит так называемая "нейрализация" развития. Такие эмбрионы представляют собой сверхразвитую нервную закладку, в которой практически нет или очень мало эпидермальных клеток (отсюда название – нейрогенные локусы).
Примером нейрогенного влияния мутации одного из таких генов является доминантная мутация Notch, описанная еще в 1940 г. В гомозиготном состоянии она детальна, но обнаруживает лишь небольшой морфологический дефект жилкования крыла в гетерозиготном состоянии. У гомозиготных по этой мутации эмбрионов дрозофилы увеличено число развивающихся из эктодермы нейроб-ластов, а ткани других производных эктодермы, например кожных покровов, развиваться не могут. У таких эмбрионов формируется нервная система, у которой общий объем клеток, по крайней мере, в 3 раза больше, чем в норме. Мезодерма остается неразвитой. Эффекты подобных мутации на ход процессов развития обшей схемы тела и основных органов у разных организмов рассматриваются в обзорных статьях Л. И. Корочкина (1989, 1991, 1992), посвященных процессам генетического контроля развития. Гипернейра-лизованные, гомозиготные по этой мутации эмбрионы, которые через некоторое время должны погибнуть, были использованы Л.И. Корочкиным и С.В. Савельевым как материал для трансплантации в мозг земноводного – шпорцевой лягушки Хепорш laevis – с целью изучения свойств развития подобных гетеротрансплантатов (Короч-кин, 1992).
Симметричную группу генов, "ведающих" формированием э&б-риональных нервных клеток – нейробластов, составляют так называемые "антинейрогенные локусы. Мутации этих генов дают спектр аномалий, при которых также нарушается развитие нервной системы (например, мутация по комплексу Ac-Sc).
Пример мутации одного из таких генов (или генного кластера) дает мутация Delta, также летальная в гомозиготном состоянии и также вызывающая аномальное жилкование крыла в гетерозиготе. Гомозиготные по этой мутации эмбрионы обнаруживают чрезмерное развитие эпидермальной ткани при аномально малом числе нейробластов.
8.5.3.2."СУДЬБА" ЭМБРИОНАЛЬНЫХ КЛЕТОК И ДИФФЕРЕНЦИРОВКА НЕЙРОНОВ. ГЕНЕТИЧЕСКИЕ МОЗАИКИ И ХИМЕРЫ. Различная "судь-
ба", т.е. направление будущей дифференцировки эмбриональных клеток-предшественниц ЦНС детерминируется на ранних этапах эмбриогенеза – на стадии бластулы у дрозофилы и стадии нервного гребня у мыши. Прослеживая судьбу поколений клеток в процессе развития ЦНСмлекопитающих, и в частности мыши, исследователи делают заключение о том, что генетически детерминированная судьба клетки сказывается не столько на окончательном положении в мозге, которое она займет как потомок клетки-родоначальницы, сколько на функциональных свойствах и количестве нейронов данного класса.
Генетические исследования развития в их традиционном варианте возможны лишь при наличии генетической изменчивости по тому или иному признаку, т.е. при выявлении и анализе эффектов соответствующих мутаций. Примером могут служить упоминавшиеся выше неврологические мутации дрозофилы – shaker, hyperkinetic (вызывающие судороги при впадении в эфирный наркоз), мутации cacophony, fruitless, stick (с нарушениями процесса спаривания), а также неврологические мутации мыши – reeler, weaver, quaking, waltzer и др.
Однако в случае очень многих мутаций экспрессия аномального гена вызывает гибель зародыша. В то же время иногда оказывается возможным реконструировать функцию нормального аллеля данного гена. Если бы можно было выделить мутации нескольких генов, экспрессирующихся на последовательных стадиях пренатального онтогенеза, это дало бы достаточно полную картину развития нервной системы. Наиболее вероятно, что такую информацию можно будет получить, изучая развитие дрозофилы, не только потому, что у нее выявлены нейрогенные и антинейрогенные локусы (см.: 8.5.3.1), но и потому, что у этого вида можно использовать чрезвычайно плодотворный метод генетических мозаиков.
Сходный методический подход у мышей обеспечил создание химерных и трансгенных животных.
Генетические мозаики.С помощью этого метода удается проследить судьбу измененных мутацией клеток и тканей на всем протяжении эмбриогенеза.
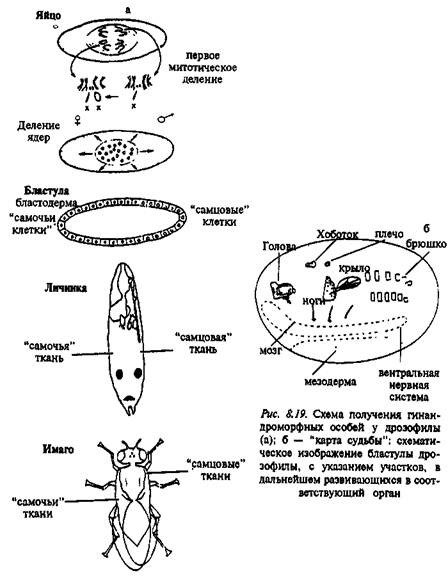
 Насекомые. Истинными генетическими мозаиками считаются животные, клетки которых происходят из одной зиготы, но несут, тем не менее, определенные генетические различия. Наиболее известным примером таких мозаиков являются гинандроморфные особи, описанные у паразитических ос Habrabracon juglandi П. Уайтингом. Гинандромор-фы, т.е. особи, имеющие ткани и самца, и самки, очень редко (1 случай из 1000– 10000) выводятся из аномальных яиц с двумя ядрами, из которых бывает оплодотворено только одно. Женские ткани развиваются из диплоидного
Насекомые. Истинными генетическими мозаиками считаются животные, клетки которых происходят из одной зиготы, но несут, тем не менее, определенные генетические различия. Наиболее известным примером таких мозаиков являются гинандроморфные особи, описанные у паразитических ос Habrabracon juglandi П. Уайтингом. Гинандромор-фы, т.е. особи, имеющие ткани и самца, и самки, очень редко (1 случай из 1000– 10000) выводятся из аномальных яиц с двумя ядрами, из которых бывает оплодотворено только одно. Женские ткани развиваются из диплоидного
ядра, а мужские – из неоплодотворенного, гаплоидного. Если ткани, развившиеся из оплодотворенного яйца, имеют четкие морфологические отличия, например измененный цвет глаз или аномальное жилкование крыльев, то легко видеть, что тело гинандроморфной особи представляет собой мозаику из тканей самца и тканей самки (рис. 8.18). Наблюдая за поведением таких ос, Уайтинг показал, что насекомые ведут себя либо как самец, либо как самка в зависимости от того, как распределяются на теле участки "самцовых" и "самочьих" тканей (см.: Эрман, Парсонс, 1984).
У дрозофилы мозаичные по тканям самца и самки особи получаются, когда в скрещивание берутся самки с так называемой кольцевой ^-хромосомой. Эта кольцевая структура неустойчива и часто утрачивается в период ранних митотических делений эмбрионов женского пола, которые получили одну кольцевую, а одну нормальную А1 хромосомы. Клетка, в которой остается только одна JT-xpo-мосома, дифференцируется по мужскому типу (поскольку у дрозофилы особи с генотипом ХО – самцы). Мозаицизм обнаруживается по рецессивным генам, локализованным в Х-хромосоме, а также по тем признакам, развитие которых определяется генетической программой, свойственной одному или другому полу (рис. 8.19; 8.20).
Благодаря работам С. Бензера и его коллег, проведённым в 60–70-е годы, в настоящее время имеется достаточно полная картина так называемой "карты судьбы" ("fate map") – топографического расположения на бластуле участков, из которых впоследствии развивается тот или иной орган или часть тела дрозофилы (см.: Бензер, 1975). Основные успехи ней-рогенетики и генетики поведения дрозофилы базируются именно на использовании метода гинандроморфных мозаиков.
Млекопитающие. Единственный случай сходного типа мозаицизма у позвоночных описан еще в начале 70-х годов. Это исследование было посвящено моза-ичности в проявлении мутации sh-1 мыши, затрагивающей строение кортиева органа. Анализировали фенотип самок мышей, гомозиготных по sh-1 и имеющих в гетерозиготном состоянии так называемую транслокацию Катганаха (транслокация – это хромосомная перестройка, при которой фрагмент одной хромосомы соединяется с другой). При упомянутой транслокации фрагмент 7-й хромосомы с мутантным аллелем sh-1 оказался соединенным с А"-хромо-сомой. Как известно, в каждой из клеток тела самки в активном состоянии находится только одна Af-хромосома, а вторая инактиви-рована. Поскольку в случае данной транслокации ген sh-1 был соединен с одной из А'-хромосом, а мутация эта рецессивна, то в тех клетках, где была инактивирована А"-хромосома, несущая транслокацию (и ген sh-1), эффект мутантного гена не обнаруживался. Если же была инактивирована А-хромосома, не имевшая транслокации, то оба гена sh-1 были активны и проявлялся эффект рецессивной мутации. Фенотипически это выражалось в том, что в кортиевом органе участки мутантных и нормальных клеток перемежались.

Химеры млекопитающих. Животных с генетически неоднородным организмом можно получать и в специально спланированных эмбриологических экспериментах (Мак-Ларен, 1979) – речь идет о химерах. Получение химер млекопитающих состоит из нескольких этапов. При использовании агрегационного метода извлеченные из половых путей самки эмбрионы на стадии дробления приходят в соприкосновение друг с другом, в результате чего они сливаются в один. С помощью инъекционного метода в бластоцисту эмбриона вводятся клетки другого эмбриона или другие донорские клетки (например, клетки определенной опухоли, клетки костного мозга и т.д.). На следующем этапе химерный эмбрион переносят в матку приемной матери.
Для распознавания отдельных компонентов химерного организма необходимо, чтобы ткани разного происхождения имели четкие и простые маркеры. Таким маркером может быть особенность пигментации, наличие редких форм изозимов, антигены, хромосомные транслокации и т.п.
Получение химерных животных в настоящее время налажено во многих лабораториях. Проблема подбора адекватных маркеров (морфологических – цвет шерсти, или биохимических – изофер-менты) для анализа "происхождения" того или иного участка мозга химерного животного, как правило, бывает достаточно трудной. Для такого маркирования используются, например, межлинейные генетические различия в локусе структурного гена бета-галактозида-зы. Этот фермент обнаруживается цитохимически в крупных нейронах. Нередко используют также антигенные различия в генопро-дуктах разных аллелей гена глюкозофосфатизомеразы.
Большинство неврологических мутаций мыши (это, как правило, аномалии строения мозжечка и/или внутреннего уха) рецессивны, т.е. их эффект проявляется в гомозиготном состоянии, а гетерозиготные особи практически не отличаются от нормы. В то же время особи, гомозиготные по этим мутациям, имеют резко сниженную жизнеспособность и поэтому трудны для изучения. Получение мышей-химер, составленных из нормальных и мутантных тканей, позволяет изучать мозг, мозаичный по генетическому составу. При удачном подборе маркеров можно увидеть, что даже рядом расположенные нейроны одного класса (например, клетки Пуркинье) имеют разный генотип. Как правило, неврологический дефект у таких химерных мышей не проявляется, однако на нейроанатоми-ческом уровне можно установить, какой именно тип клеток несет первичный дефект мутации, а какие клетки страдают вследствие нарушений нормальных эпигенетических отношений с первично аномальными. Данные по мутации Lurcher, упоминавшиеся выше (см.: 8.5.1), были получены именно таким методом. Анализ особенностей поведения мышей-химер также представляет интерес для выяснения роли генотипа в определении особенностей той или иной реакции. С мутацией Lurcher, например, были проведены эксперименты, показавшие, что у гетерозигот lc/+ сильно нарушена локомоция, тогда как у мышей-химер, "составленных" из эмбрионов, гомозиготных по этой мутации, и нормальных зародышей, таких изменений не было (см. также: Goldowitz et al., 1992).
На серийных срезах мозга, например на срезах ствола и мозжечка химерных мышей, у которых нормальные и мутантные нейроны различаются визуально, можно определить общее количество нейронов в моторном ядре лицевого нерва, а также число клеток Пуркинье мозжечка с нормальным и мутантным фенотипами. Статистические оценки позволили заключить, что родоначальниками клеток Пуркинье в мозге мыши являются 8 клеток, а нейроны ядра лицевого нерва происходят от 12 клеток-предшественниц.
У мышей известны межлинейные различия по числу нейронов той или иной структуры мозга. Есть веские основания предполагать, что одной из причин этой изменчивости могут быть различия в числе клонов, формирующих данный участок мозга, т.е. в числе "клеток-родоначальниц" и/или в размере клона, т.е. в числе митотических делений исходной клетки перед началом дифференцировки.
Нейрохимические, морфологические и физиологические различия между инбредными линиями мышей, описанные к настоящему времени, несомненно, определяются значительным числом локусов. Современные методы генетического анализа, использующие множественные маркеры, а также конгенные и рекомбинантные линии (в частности, метод картирования QTL – quantitative trait loci), позволяют описывать такие межлинейные различия. Возможно, они помогут и в описании структурных различий в мозге, которые являются ключевыми в возникновении межлинейных различий в поведении.
Трансгенные мыши.На основе метода получения химерных животных был разработан принципиально новый подход к исследованию генетических закономерностей формирования организма животного. Он получил название "метода создания трансгенных животных", о котором говорилось в разделе 8.5.2. Этот метод позволял исследовать особенности развития мозга и поведения животных, у которых были искусственно изменены или "выбиты" (отсюда название "нокаут", knock-out) ген или гены, кодирующие определенные структурные и/или регуляторные белки (см.: 8.6.3.3 и 8.6.4.3).
8.5.4. НАРУШЕНИЯ РАЗВИТИЯ МОЗГА МЫШИ. НЕВРОЛОГИЧЕСКИЕ МУТАЦИИ
Используя мутации, затрагивающие морфогенез мозга, прижизненное окрашивание отдельных клеток с последующим прослеживанием распределения метки, а также создание мышей-химер, можно проследить судьбу отдельных клеточных клонов при развитии мозга и выявить характер взаимодействия между ними. Важным свойством дифференцировки нейробластов млекопитающих является определение окончательных свойств нейронов на таких стадиях развития, когда фенотипически клетка еще не дифференцирована.
Какие же характерные для нейрона свойства должна проявить такая рано детерминированная клетка в ходе дифференцировки? К ним относятся: особенности морфологического строения, медиатор-ная специфичность, определенный характер ее связей с другими нейронами, общее число нейронов данного фенотипа, а также определенный численный баланс клеток разных популяций.
Очевидно, что генетическая программа развития нейрона развертывается на основе тех эпигенетических механизмов, о которых упоминалось выше. Все перечисленные выше свойства детерминированной нервной клетки формируются как результат экспрессии соответствующих генов в определенные моменты времени, которые совпадают с формированием (вследствие работы других групп генов) градиентов концентрации биологически активных веществ (гормонов, факторов роста и др.) – компонентов внешней среды нейрона, необходимых для его развития.
Большой фактический материал по развитию ЦНС, в частности, при неврологических мутациях мыши, заставляет сделать вывод, что мутационные события или внешние экспериментальные воздействия могут значительно повлиять на окончательное пространственное положение нейронов, но не на их форму или функциональные свойства. Ниже это иллюстрируется более подробным описанием неврологических нарушений при некоторых мутациях.
Следует отметить, что изучение неврологических мутаций мыши дало огромный материал для понимания генетического контроля пре- и постнатального онтогенеза мозжечка. Особое значение, которое придается этим данным, связано с тем, что подобные мутации могут служить удобными и полезными моделями генетических дегенеративных заболеваний человека. Это относится прежде всего к мутациям "демиелинизации", например jimpy, shiverer и др. Молекулярная биология этих мутантных генов изучена достаточно подробно.
У собак описана мутация демиелинизации – "shaking pup". Она рецессивна и сцеплена с ^-хромосомой. Дефекты этого типа затрагивают синтез эволюционно консервативных белков миелина. Де-миелинизация, при которой ухудшаются условия проведения нервных импульсов по аксонам, сопровождается снижением всех функций мозга и гибелью животного. При "shaking pup" дефект, по всей видимости, связан с заменой одной пары оснований в гене, кодирующем один из таких белков. Столь сильные изменения в функциональных свойствах белков миелина определяются, по всей видимости, именно большим эволюционным консерватизмом белков этой группы. У мутантных особей, начиная с 10–12-дневного возраста, появляется мышечный тремор (характерный для мутаций демиелинизации у всех видов млекопитающих). У мутантных собак, в отличие, например, от некоторых мутаций мышей, миелин разрушается не полностью, и они живут относительно дольше, чем му-тантные крысы и мыши. В то же время у 4–16-месячных мутантных щенков количество миелина составляет лишь 2,4% от контроля. У таких собак резко снижено количество олигодендроцитов – глиальных клеток, продуцирующих миелин.
Неврологические мутации мыши имеют аутосомную локализацию. Они, за редкими исключениями, рецессивны, их наиболее частый и наиболее заметный морфологический дефект – недоразвитие органов внутреннего уха и/или мозжечка. Мыши с неврологическими мутациями характеризуются нарушениями движений, походки, аномалиями позы, отклонениями в поведении и в способности к обучению.
Нейроны большинства корковых структур мозга млекопитающих образуются в генеративных зонах, которые пространственно отделены от мест расположения этих клеток во взрослом мозге. Так, предшественники нейронов древней (обонятельной) и старой (аммонов рог) коры, а также новой коры формируются в вентрикулярных и субвентрикулярных зонах переднего мозга. Предшественники гранулярных клеток зубчатой фасции гиппокампа формируются in situ, предшественники клеток Пуркинье – в вентральной зоне вдоль дорсального края 4-го желудочка, а разные классы клеток коры мозжечка образуются в пространстве между наружным гранулярным слоем и развивающимся молекулярным слоем.
По окончании митозов большая часть корковых нейробластов мигрирует на значительные расстояния. На окончательных позициях они распределяются по слоям (выявляется дифференцировка на классы) в направлении (в случае корковых структур) от внутреннего слоя к наружному.
 Изучение мутаций reeler и weaver показало, что на окончательное положение нейронов в слоях влияют два независимых нейрогенети-ческих механизма – миграция клеток и распределение их по слоям. В то же время ключевые события, вызывающие нарушения и га-бель клеток наружного гранулярного слоя мозжечка, происходят еще раньше (примерно в первый день после рождения).
Изучение мутаций reeler и weaver показало, что на окончательное положение нейронов в слоях влияют два независимых нейрогенети-ческих механизма – миграция клеток и распределение их по слоям. В то же время ключевые события, вызывающие нарушения и га-бель клеток наружного гранулярного слоя мозжечка, происходят еще раньше (примерно в первый день после рождения).
При мутации reeler развитие гранулярных клеток замедляется, отмечается также их ускоренная гибель. Нарушение цитоархитектоники мозжечка, а в случае мутации reeler еще коры и гиппокампа, – лишь наиболее заметный эффект этой группы неврологических мутаций (рис. 8.21).
У reeler выявлены отклонения в строении ряда ядер продолговатого мозга и базальных ганглиев, а также в особенностях распределения на нейронах рецепторов разных классов. При этой мутации (rt) нарушено расположение слоев корковых структур. Аномальная стратификация обнаруживается у них с момента закладки корковой пластинки (13–14-й дни эмбрионального развития). Полиморфный слой клеток располагается на поверхности, слои мелких пирамид (в норме это 3-й и 4-й слои) находятся в глубине, тогда как 5-й слой нормального мозга – ближе к поверхности. Характер распределения восходящих моноаминергических волокон в подкорковых структурах не отличается от нормы, однако их распределение по слоям коры у rl имеет характерные черты. Эти афференты не ветвятся в наружном слое коры и не идут каждое отдельно, а собираются в пучки. В то же время места их окончаний в нормальном и мутантном мозге гомологичны.
Таким образом, нарушение архитектоники слоев новой коры не препятствует "узнаванию" растущими волокнами соответствующих клеток-мишеней.
На срезах мозга мышей, гомозиготных по rl, было показано, что при этой мутации ослаблен процесс формирования долговременной постсинаптической потенциации, а в stratum radiatum и stratum moleculare-lacunosum присутствует множество клеток, иммунореак-тивных к парвальбумину (нередко это свойство находят у ГАМК-ер-гических вставочных нейронов).
Нормальный аллель гена rl обеспечивает, таким образом, сопряжение во времени и в пространстве процессов миграции и созревания клеточных элементов.
Считается, что наиболее правдоподобны два объяснения причин дефекта строения мозга при мутации rl: уменьшение сил сцепления (адгезии) между нейронами и волокнами радиальной глии к концу периода миграции и изменение этих сил в постмиграционный период. Было действительно продемонстрировано, что в коре мышей-мутантов по rl глиальные волокна располагаются тангенциально к боковым стенкам формирующихся "бочонков" – специфических агрегаций корковых нейронов, а не радиально, как в норме. Полагают, что в развивающейся коре радиальные глиальные волокна служат "гидами" для мигрирующих молодых нейробластов, которые проделывают свой путь к коре из вентральной зоны, где происходят митозы.
При исследовании гистогенеза мозжечка у мышей-химер, т.е. у животных, ткань мозга которых состояла из нормальных и мутант-ных клеточных элементов, была подтверждена роль глиальных элементов. В целом для мутации rl характерно общее недоразвитие мозжечка с почти полным отсутствием клеток-зерен. Клетки Пур-кинье у этих мутантов (а также при ряде других мутаций) развиваются в отсутствие контактов с аксонами гранулярных клеток – параллельными волокнами, вместо которых с клетками Пуркинье контактируют мшистые волокна, в норме приходящие в гранулярный слой. При этой мутации клетки Пуркинье расположены беспорядочно и не формируют четкого слоя. У мышей-химер аномальные участки мозжечковой коры "вкраплены" в кору с нормальной структурой. В то же время клетки Пуркинье, которые маркированы как генотип rl/rl, можно найти как в нормальных, так и в му-тантных участках ткани.
Согласно результатам иммуногистохимического исследования мозжечка, влияние мутации rl на миграцию элементов может осуществляться в более ранние сроки, еще до начала миграции. Возможно, что эффект действия мутантного гена начинается в период формирования нейробластов.
У мышей-химер, "составленных" из нормальных клеток и генотипа staggerer (sg), в клетках Пуркинье мутантного фенотипа присутствуют все аномалии строения, свойственные этой мутации. Известно, что у мутантов sg гранулярные клетки мигрируют и дифференцируются нормально, но к 4-й неделе жизни начинают прогрессивно дегенерировать, а клетки Пуркинье при этой мутации сохраняются в количестве 10% от нормы.
При мутации weaver (wv) дефект обусловлен отсутствием миграции гранулярных клеток и последующей их дегенерацией. Таким образом, мутантный локус действует непосредственно на гранулярные клетки.
Примером еще одного типа нарушений регуляторных процессов нейрогенеза является мутация stambler, при которой структура мозжечка не дезорганизована, но общее число и гранулярных клеток, и клеток Пуркинье уменьшено. В определенный период развития в этих нейронах начинаются нарушения внутренней структуры, которые, однако, затем исчезают.
Приведенные примеры показывают, что метод создания мозаичных особей и метод создания химерных мышей, позволяют исследовать функции генов, реализующих эффекты на стадиях органогенеза.
S.5.5. ЭКСПРЕССИЯ ГЕНОВ В МОЗГЕ
В процессах развития нервной ткани важная роль принадлежит временному режиму экспрессии генов, механизмы которого тесно связаны с процессами межтканевых и межклеточных взаимодействий.
Экспрессия специфических генов в определенные моменты времени определяет, каким будет соотношение медиаторных или гормональных продуктов в конкретный период развития, и как будут формироваться морфологические особенности мозга – его отдельные структуры и связи между ними.
Рассмотрим некоторые особенности формирования медиаторной специфичности гипоталамуса. В одной из первых работ в этой области было показано, например, что в паравентрикулярных и суп-раоптических ядрах гипоталамуса процессинг (т.е. формирование малых пептидных молекул из белков-предшественников с помощью ферментов-протеаз), обеспечивающий "наработку" окситоцина и аргинин-вазопрессина, происходит в разные сроки онтогенеза. В результате этого, начиная с определенного момента развития, нейроны названных ядер имеют четкие нейрохимические различия.
Особенности экспрессии генов в мозге исследуются в настоящее время все более интенсивно. Такие методы позволяют, с одной стороны, оценивать функциональную роль тех или иных воздействий на мозг, точнее, на его генетический аппарат. С другой стороны, нарастает число работ, в которых исследуются изменения экспрессии специфичного для нервной ткани гена при каких-либо воздействиях, например при сенсорной стимуляции, при стрессе, разрушении отделов мозга и т.п. В этом отношении можно уверенно утверждать, что рождается новый методический подход к оценке физиологического состояния мозга, сходный с методом исследования электрофизиологических процессов в нервной ткани. Наиболее полно в этом плане изучены так называемые протоонкогены, или быстрые гены раннего действия, относящиеся к семействам генов c-fos, c-jun и др.
Эти гены кодируют белки, являющиеся так называемыми факторами транскрипции, т.е. молекулами, которые определяют включение в работу отдельных генов и групп генов, или же их репрессию. Не вдаваясь в детали описания этих молекулярных событий, отметим, что гены раннего действия были первоначально описаны как факторы, способствующие или сопутствующие формированию злокачественных новообразований. Позднее было показано, что в нормальных условиях эти гены интенсивно экспрессируются в период эмбрионального и частично постэмбрионального развития. В то же время их экспрессия проявляется через очень короткий промежуток времени после некоторых физиологических, а также патологических воздействий на мозг. Примером может служить повышение экспрессии гена c-fos как реакция на развитие судорожной активности. Поскольку экспрессия этих генов оказывается, видимо, первым событием в каскаде, ведущим к изменению экспрессии генетических элементов в ряде структур мозга, то очевиден большой интерес исследователей к ним (см.: Анохин, Судаков, 1993). У крыс линии КМ, выделенной по высокой чувствительности к звуку (см.: 8.6.5.1), в период после судорожного припадка экспрессия генов этой категории оказывается сниженной.
Иммуногистохимическим методом в ткани мозга крыс выявлены специфические белковые продукты экспрессии ранних генов. Они были найдены в нейронах примерно 100 ядер и областей мозга интактной крысы (c-Jun, JunB, JunD, c-Fos, FosB, Krox-24). Был составлен своеобразный "атлас" экспрессии соответствующих ранних генов (Herdegen et al, 1995), каждый из которых имел свой "индивидуальный профиль" экспрессии в мозге. Полагают, что активация семейств таких генов определяется разными механизмами и происходит при разных физиологических состояниях мозга и организма в целом.
8.6.