Введение
Министерство образования и науки РФ
Волгоградский государственный архитектурно–строительный
Университет
Кафедра «Водоснабжение и водоотведение»
Химия воды
Методические указания к лабораторным работам по дисциплине
«Химия воды»
Волгоград 2013
Введение
Лабораторный практикум составлен в соответствии с рабочей программой по дисциплине «Химия воды».
Практикум составлен с учетом того, что студенты уже прослушали лекции по курсу «Химия», «Прикладная химия» и достаточно ознакомлены с работой в химической лаборатории и имеют определенные теоретические представления об основных физических и химических свойствах воды. Одновременно с выполнением лабораторного практикума читается курс лекций «Химия воды», где студенты знакомятся с основными характеристиками природных и сточных вод.
1. Цели и задачи практикума
Целью лабораторного практикума является практическое знакомство студентов с оборудованием и посудой, которые применяются для выполнения анализов воды в производственных и исследовательских лабораториях. Будущий инженер, выполняя исследовательские работы, приобретает практические навыки, необходимые для его дальнейшей деятельности.
Задачей лабораторного практикума является практическое усвоение курса ««Химия воды»», а также получение навыков самостоятельного проведения лабораторных работ исследовательского характера.
Лабораторный практикум охватывает работы по изучению различных свойств воды, изучение методик определения показателей качества воды включает 6 работ, которые предусматривают:
Работа №1. Определение физических показателей качества воды.
Работа №2. Определение кислотности воды.
Работа №3. Определение щелочности воды.
Работа №4. Определение жесткости воды. Определение концентрации ионов кальция и магния в воде.
Работа №5. Определение различных форм углекислоты.
Работа №6. Определение пермаганатной окисляемости воды.
Перед проведением любой лабораторной работы студенты должны ознакомиться с целью, методикой выполнения работы и необходимых расчетов, устройством прибора, уметь обращаться с химической посудой, реактивами, а также обязаны подробно ознакомиться с основными положениями «Инструкции по технике безопасности для работающих в химической лаборатории». По окончании работы студенты должны оформить отчет в лабораторном журнале, указав основные расчеты, проанализировать полученные данные, сделать выводы о качестве анализируемой воды.
2. Правила техники безопасности в лаборатории
Проведение лабораторных работ требует строжайшего соблюдения студентами правил безопасности работы. Все реактивы должны находиться в закрытой посуде с четкой надписью, указывающей название и концентрацию реактива. При пользовании растворами крепких кислот и щелочей необходимо исключать возможность попадания их на руки, одежду, лицо. Отбор концентрированных жидкостей производить мерными цилиндрами или пипетками с резиновыми баллончиками. Разлитые кислоты или щелочи необходимо сразу же засыпать песком, нейтрализовать, после чего провести уборку. При пользовании нагревательными приборами необходимо следить за исправностью проводки, степенью нагрева розеток, штепсельных вилок, не следует оставлять нагревательные приборы без присмотра. Нагретые предметы, посуду рекомендуется брать щипцами, колбодержателями, жгутом из полотенца.
Каждый студент должен соблюдать санитарные меры предосторожности при выполнении лабораторных работ. Необходимо:
– избегать непосредственного контакта с анализируемой водой и осадком;
– анализы проводить в резиновых перчатках;
– использованную лабораторную посуду необходимо обеззараживать дезинфицирующем раствором;
– по окончании анализов привести рабочее место в порядок и тщательно вымыть руки.
Лабораторная работа №1
Определение физических показателей качества воды.
Цель работы: изучение методик определения физических показателей качества воды (температура, цветность, запах, вкус, плотность).
Точность анализа воды во многом зависит от правильного отбора пробы. Так как многие физические и химические показатели воды изменяются во времени, то для отдельных определений в официальных изданиях указан предельной срок хранения пробы. Отбирают пробы в склянки с резиновыми или притертыми пробками, которые предварительно ополаскивают исследуемой водой. Помещая на хранение, пробу консервируют хлороформом (2 мл на I л воды). Перед анализом, в случае необходимости, проводят предварительную подготовку пробы: удаляют взвешенные вещества (фильтрованием, центрифугированием, отстаиванием), упаривают в фарфоровых чашках.
Оценивания качество воды, в первую очередь учитывают такие важные физические показатели, как температура, цветность, запах, вкус, прозрачность, мутность.
1.1. Определение температуры воды
В водопроводных и насосных установках температуру определяют, погружая термометр в струю стекающей воды. Отсчет производят, не вынимая термометр из воды. При отдельных определениях термометр помещают на 3 – 5 мин. в большой сосуд с водой. Оптимальные температурные пределы для питьевой воды 7 – 120С.
1.2. Определение цветности воды
Цветность вод обусловлена наличием большого количества взвешенных частиц, ее определяют после отстаивания, фильтрования или центрифугирования. Оценивают цветность в градусах дихромат – кобальтовой шкалы.
Качественную оценку цветности производят, сравнивая ее с дистиллированной водой. Для этого в специальные пробирки из бесцветного стекла наливают отдельно исследуемую воду и дистиллированную. На фоне белого листа бумаги при дневном освещении воду рассматривают сверху и сбоку. На основании этого оценивают цветность, т.е. указывают наблюдаемый цвет (слабо-белый, бурый и т.п.). При отсутствии окраски вода считается бесцветной. Количественно цветность определяют по дихромат – кобальтовой шкале.
Ход работы. Мутную воду предварительно отфильтровывают. Для определения применяют бесцветные цилиндры диаметром 30 мм и высотой 350 мм.
1.3. Определение запаха воды
Запах сточной воды определяют качественно при открывании пробы. Вначале дают качественную характеристику запаха по соответствующим признакам (болотный, землистый, гнилостный, рыбный, ароматический и т.п.). Интенсивность оценивают по пятибалльной шкале (табл. 1) при температуре 200С и 600С.
Ход работы. В колбу с притертой пробкой налить исследуемую воду (2/3 объема) и сильно встряхнуть в закрытом состоянии. Затем открыть и сразу же отметить характер и интенсивность запаха.
Таблица 1
Характер запахов и вкусов по степени их интенсивности
| Запах (вкус) | Интенсивность | Оценка в баллах |
| Отсутствует | Не ощущается | |
| Очень слабый | Обнаруживается только опытным исследователем | |
| Слабый | Обнаруживается потребителем в том случае, если обратить его внимание | |
| Заметный | Легко обнаруживается потребителем | |
| Отчетливый | Вода непригодна для питья | |
| Очень сильный | Вода непригодна для питья |
1.4. Определение вкуса воды
Различный вкус воды может быть обусловлен присутствием химических соединений (хлористого натрия, солей железа, марганца, магния и др.), а также продуктами жизнедеятельности водных организмов. Согласно СанПиН 2.1.4.1074-01 различают четыре вида вкуса: горький, сладкий, кислый, соленый. Остальные вкусовые ощущения характеризуются как привкусы. Количественно интенсивность вкуса определяют по той же шкале, что и запах (см. табл.1).
Воду, безопасную в санитарном отношении, исследуют в сыром виде, в других случаях – после кипячения и последующего охлаждения до 18 – 200С. Нельзя пробовать загрязненную воду. Для определения характера и интенсивности вкуса 10 – 15 см3 исследуемой воды набирают в рот и держат 10 – 15 сек, не проглатывая. Интенсивность вкуса питьевой воды, согласно СанПиН 2.1.4.1074-01, не должна превышать 2 баллов (см. табл. 1).
1.5. Определение плотности воды
Плотность чистой воды зависит от температуры. При 150С она равна 0,99913 г/см3, при 200С – 0,99823 г/см3. Плотность сточных вод зависит и от растворенных соединений. Обычно плотность воды близка к единице.
Плотность воды с точностью до третьего десятичного знака можно определить ареометром. Исследуемую воду налить в цилиндр на 100 мл. Осторожно опустить в нее ареометр. Уровень воды должен оказываться в пределах шкалы ареометра. Если шкала ареометра будет выше или ниже уровня воды, то следует заменить ареометр. Показание шкалы ареометра на уровне поверхности воды соответствует ее плотности при данной температуре.
1.6. Определение мутности воды
Мутность воды обусловлена присутствием в природной воде нерастворенных и коллоидных веществ неорганического и органического происхождения. Мутность воды характеризуется терминами: прозрачная, слабая муть, мутная и т.д.
Определить мутность воды можно весовым методом, визуальным, мутномером, фотоэлектронным тиндалеметром и фотоэлектрическим колориметром.
1.6.1 Гравиметрический метод
Ход работы. 500 – 1000 мл мутной воды профильтровать через плотный фильтр (диаметром 9 – 11 см), предварительно высушенный при 1050С в течение 1,5 – 2 часов и взвешенный в закрытом бюксе на аналитических весах. После фильтрования фильтр с осадком перенести в тот же бюкс, высушить при 105 – 1100С 1,5 – 2 часа, охладить в эксикаторе и взвесить на аналитических весах в закрытом бюксе. Содержание взвешенных веществ в исследуемой воде рассчитать по формуле:
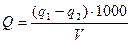 , мг/л,
, мг/л,
Q – содержание взвешенных веществ в воде, мг/л,
q1 – масса бюкса с просушенным фильтром после фильтрования воды, г,
q2 – масса бюкса с просушенным фильтром до фильтрования, г,
V – объем профильтрованной воды, мл.
1.6.2 Визуальный метод
Прозрачность воды зависит от её мутности. Мерой прозрачности служит высота водяного столба, сквозь который ещё можно прочитать шрифт определенного типа.
Результаты указывают в сантиметрах. Определяют высоту водяного столба, сквозь который типографический шрифт становится плохо различим.
Ход работы. Цилиндр, под дно которого подложен хорошо освещенный шрифт, наполняют перемешанной пробой воды до такой высоты, чтобы буквы, рассматриваемые сверху, стали плохо различимы. Пробу просматривают при рассеянном дневном освещении. Определение повторяют несколько раз. Записывают высоту водяного столба в сантиметрах и вычисляют среднее значение. Согласно СанПиН 2.1.4.1074-01 прозрачность питьевой воды должна быть не менее 30 см.
Вопросы к отчету лабораторной работы №1
1) Назовите основные физические показатели качества воды. Причины, обуславливающие их наличие (кратко).
2) Температура. На какие процессы, происходящие в воде, она влияет. В каких единицах измеряется. Каким способом производят измерение температуры. Оптимальное значение.
3) Какие примеси природных вод обуславливают запах, вкус и привкус воды?
4) Методики определения вкуса и запаха. Оптимальные значения.
5) Что такое дезодорация? Методы устранения привкусов и запахов воды.
6) Прозрачность и мутность. Какие примеси природных вод обуславливают мутность. Способы определения. Оптимальные значения.
7) Какие вещества, присутствующие в водоемах, обуславливают цветность воды. Методы определения. Оптимальное значение.
Лабораторная работа №2
Определение кислотности воды.
Цель работы: изучить методики определения кислотности (свободной и общей) воды.
2.1 Определение кислотности воды
Кислотность воды может быть обусловлена наличием свободных кислот или солей, образованных слабыми основаниями и сильными кислотами (например, FeSO4, AlCl3, ZnSO4 и др.). В поверхностных природных водах и в большинстве подземных кислотность воды обычно вызывается присутствием свободной угольной кислоты. В производственных сточных водах кислотность может быть вызвана наличием свободных сильных (HCl, H2SO4, HNO3) и слабых кислот (НСN, H2S и др.), а также солей тяжелых металлов. При гидролизе солей, образованных сильной кислотой и слабым основанием, происходит снижение величины pH до 4,5 и ниже.
Определяют кислотность воды методом нейтрализации, в основе которого лежит реакция взаимодействия кислоты с основанием. Общая кислотность воды характеризуется количеством сильного основания, например гидроксида натрия, необходимого для нейтрализации соединений, содержащихся в воде. Она определяется числом мг-экв/л сильного основания, необходимым для нейтрализации веществ, содержащихся в 1 л воды, рН которой равна 8,3. Если рН воды выше 8,3, то кислотность воды принимается равной нулю. В тех случаях, когда рН воды ниже 4,5, считается, что она обладает свободной кислотностью.
При отборе пробы воды для определения кислотности необходимо принимать меры для уменьшения контакта воды с углекислотой воздуха. С этой целью используют герметически закрывающиеся пробоотборники, а из крана воду отбирают при помощи резиновой трубки, которая опускается на дно склянки. Вода должна вытеснить воздух и несколько раз смениться в склянке. Для титрования используют колбы, закрытые резиновой пробкой с отверстием для подачи рабочего раствора.
Определение кислотности проводятся индикаторным и электрометрическим методами.
Проведению анализа мешают повышенная карбонатная жесткость воды (боле 4 – 5 мг-экв/л), присутствие солей тяжелых металлов, для индикаторного метода – цветность и мутность воды, свободный хлор. При значительной карбонатной жесткости воды в процессе титрования гидрокарбонаты кальция и магния переходят в труднорастворимые карбонаты, вызывая помутнение исследуемого раствора. Снять это отрицательное воздействие можно разбавлением пробы прокипяченной дистиллированной водой. При добавлении рабочего раствора щелочи, соли тяжелых металлов образуют труднорастворимые соединения, которые затрудняют определение. Уменьшить мешающие воздействие этих соединений можно добавлением небольшого количества (0,8 – 1,2 мл) раствора сегнетовой соли или кипячением пробы (при этом следует учитывать, что углекислота после кипячения практически удаляется из воды)
Электрометрический метод применим для анализа цветных и мутных вод.
2.1.1 Определение свободной кислотности
а) Индикаторный метод
Реактивы
1) 0,1н раствор NaOH;
2) метилоранж (0,03%-ный водный раствор).
Ход работы. В коническую колбу отмерить 100 мл (или другой необходимый) объем воды, прибавить 2-3 капли метилоранжа. Если раствор приобретет розовую окраску, то он имеет свободную кислотность. Титровать пробу 0,1 н раствором гидроксида натрия до перехода розовой окраски в желто – розовую, и далее рассчитать свободную кислотность по формуле:
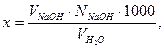
где х – свободная кислотность воды, мг-экв/л;
VNаOH – объем рабочего раствора NаOH, пошедший на титрование пробы воды, мл;
NNaOH – нормальность раствора NaOH, г-экв/л;
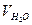 – объем пробы воды, мл.
– объем пробы воды, мл.
б) Электрометрический метод
Приборы, реактивы.
1) рН-метр лабораторный;
2) магнитная мешалка;
3) 0,1н раствор NaOH.
Ход работы. В химический стакан отмерить 100 мл воды и добавлять в нее по каплям рабочий раствор гидроксида натрия до получения значения рН = 4,5. (Расчет приведен в пункте “а”). Определение проводится для вод с величиной рН < 4,5.
2.1.2 Определение общей кислотности
а) Индикаторный метод
Реактивы:
1) 0,1 н раствор NaOH;
2) фенолфталеин (0,5 %-ный в 60%-ном этаноле).
Ход работы. В коническую колбу отмерить 100 мл, прибавить 5 – 10 капель фенолфталеина. Титровать 0,1н раствором гидроксида натрия до появления слабо-розовой, заметной на белом фоне, окраски, не исчезающей в течение 1 мин. и рассчитать общую кислотность по формуле:
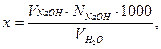
где х – общая кислотность воды, мг-экв/л;
VNаOH – объем рабочего раствора NaOH, пошедший на титрование пробы воды, мл;
NNаOH – нормальность рабочего раствора NaOH, г-экв/л;
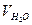 – объем пробы воды, мл.
– объем пробы воды, мл.
б) Электрометрический метод
Ход работы. По методике, описанной для определения свободной кислотности, проба вода титруется 0,1н раствором гидроксида натрия до достижения величины рН, равной 8,3. Расчет ведется по формуле приведенной в пункте “а”.
Вопросы к отчету лабораторной работы №2
1) Какие вещества, присутствующие в воде, обуславливают кислотность воды?
2) Виды кислотности и их значение для оценки качества воды?
3) Методы определения свободной и общей кислотности?
Лабораторная работа №3
Определение щелочности воды.
Цель работы: изучить методики определения щелочности (свободной и общей) воды.