Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.
Атом – наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочкиуравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен -1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда.
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 – 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N – максимальное число электронов на уровне,
n – номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии.
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
максимальным количеством электронов: на 1-м уровне не больше 2 e–, на 2-м – 8 e–,
на внешнем уровне – 8 e–;
числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
При перемещении слева направо вдоль периода металлические свойства элементов становятся все менее ярко выраженными. При перемещении сверху вниз в пределах одной группы элементы, наоборот, обнаруживают все более ярко
выраженные металлические свойства. Элементы, расположенные в средней части
коротких периодов (2-й и 3-й периоды), как правило, имеют каркасную
ковалентнуто структуру, а элементы из правой части этих периодов существуют в
виде простых ковалентных молекул.
Атомные радиусы изменяются следующим образом: уменьшаются при перемещении
слева направо вдоль периода; увеличиваются при перемещении сверху вниз вдоль
группы. При перемещении слева направо по периоду возрастает
электроотрицательность, энергия ионизации и сродство к электрону, которые
достигают максимума у галогенов. У благородных же газов
электроотрицательность равна 0. Изменение сродства к электрону элементов при
перемещении сверху вниз вдоль группы не столь характерны, но при этом
уменьшается электроотрицательность элементов.
В элементах второго периода заполняются 2s, а затем 2р-орбитали.

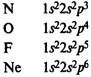
Главная подгруппа IV группы периодической системы химических элементов Д. М.
Менделеева содержит углерод С, кремний Si, германий Ge, олово Sn и свинец Pb.
Внешний электронный слой этих элементов содержит 4 электрона (конфигурация s
2p2). Поэтому элементы подгруппы углерода должны иметь некоторые черты сходства. В частности, их высшая степень окисления одинакова и равна +4.
А чем обусловлено различие в свойствах элементов подгруппы? Различием энергии
ионизации и радиуса их атомов. С увеличением атомного номера свойства
элементов закономерно изменяются. Так, углерод и кремний — типичные
неметаллы, олово и свинец — металлы. Это проявляется прежде всего в том, что
углерод образует простое вещество-неметалл (алмаз), а свинец типичный металл.
Германий занимает промежуточное положение. Согласно строению электронной
оболочки атома p-элементы IV группы имеют четные степени окисления: +4, +2, –
Формула простейших водородных соединений — ЭН4, причем связи Э—Н
ковалентны и равноценны вследствие гибридизации s- и р- орбиталей с
образованием направленных под тетраэдрическими углами sp3 -орбиталей.
Ослабление признаков неметаллического элемента означает, что в подгруппе
(С—Si—Ge—Sn—Pb) высшая положительная степень окисления +4 становится все
менее характерной, а более типичной становится степень окисления +2. Так,
если для углерода наиболее устойчивы соединения, в которых он имеет степень
окисления +4, то для свинца устойчивы соединения, в которых он проявляет
степень окисления +2. А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнению с неметаллическими элементами VII—V групп признаки неметаллического элемента р-элементы IV группы проявляют в меньшей степени. Поэтому для элементов подгруппы углерода отрицательная степень окисления нетипична.