Вычисление константы равновесия
Константу равновесия Kp можно определить экспериментально по значениям парциальных давлений или концентраций. Так как Kp требуется знать в широком диапазоне температур, то возникают существенные трудности в определении парциальных давлений или концентраций. Хотя существует метод «замораживания» химической реакции, когда газовую смесь в состоянии химического равновесия резко охлаждают, и реакции часто практически прекращаются, этот метод не дает результата в случае протекания химических реакций, не требующих высоких температур.
Поэтому основным методом определения Kp является расчетный метод, суть которого состоит в расчете Kp через L*max по формуле:
L*max = – mRT ln Kp.
Для расчета L*max, как мы знаем, необходимо знать изменение DF (для изохорно-изотермических) и DF (для изобарно-изотермических реакций). Например, для случая (p,T) = const
L*max = F1 – F2 = I1 – I2 – T(S1 – S2) = – Q p – T(S1 – S2),
где S1 и S2 – суммарные значения энтропии при температуре T соответственно для исходных веществ и продуктов реакции.
Q p измерены для различных реакций, и данные доступны.
Энтропии можно представить в виде:
S1 = f1(p, T) + S1,0;
S2 = f2(p, T) + S2,0,
где S1,0 и S2,0 – энтропии при 0°K.
Известно, что
dq = T ds и 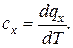
отсюда
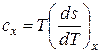 и
и 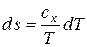 .
.
Тогда
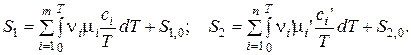
где ni и ni’ – стехиометрические коэффициенты уравнения реакции.
Подсчитать энтропии можно, если известна зависимость теплоемкостей от температуры. Кроме того, надо знать константы интегрирования S1,0 и S2,0.
Заслуга немецкого химика В. Нернста заключается в том, что он выдвинул предположение, которое потом было подтверждено практикой, получившее название теплового закона Нернста, позволяющее вычислить абсолютные значения энтропий веществ. Он пришел к выводу, чтовблизи абсолютного нуля температуры энтропии всех веществ, находящихся в равновесных состояниях, становятся неизменными и равными между собой, то есть S1,0 = S2,0 и с = 0.
В дальнейшем М. Планк доказал, что не только S1,0 = S2,0, но и то, что они равны 0.
Интеграл  должен вычисляться применительно к конкретному процессу x = const, например, изобарному. При этом надо использовать известную зависимость сx = сp = f(T).
должен вычисляться применительно к конкретному процессу x = const, например, изобарному. При этом надо использовать известную зависимость сx = сp = f(T).
В общем случае в процессе изобарного нагревания будут происходить фазовые переходы, поэтому уравнение для абсолютного значения удельной энтропии принимает следующий вид:
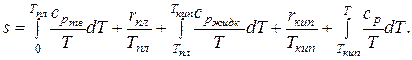
Вычислить это выражение весьма не просто, так как необходимо знать зависимости теплоемкости вещества от температуры в различных фазовых состояниях. В химических справочниках можно найти значения абсолютной энтропии веществ при стандартных условиях (p = 760 мм рт.ст., t = 25 °C). Эта величина обозначается  .
.
Из уравнения
F1 – F2 = –mRT ln Kp
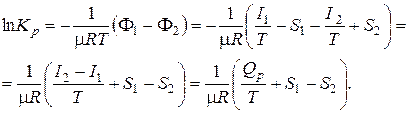
Учитывая связь между натуральным и десятичным логарифмами и значение универсальной газовой постоянной, получим:
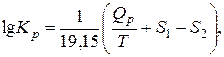
где
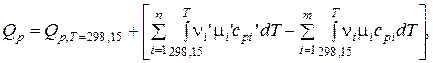
где m – число исходных веществ;
n – число продуктов реакции;
n – cтехиометрические коэффициенты;
' – относится к продуктам реакции.
Для изохорно-изотермической реакции формулы аналогичны, только надо подставлять QV и сV.
Из закона Нернста следует, что
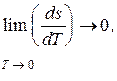
а так как
dq =Tds и 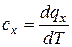 ,
,
то можно записать
 ,
,
следовательно, cx® 0 и dq ® 0 , то есть теплообмен вблизи абсолютного нуля невозможен. Отсюда следует, что невозможно охладить вещество до температуры абсолютного нуля путем отвода тепла. Абсолютный нуль температуры недостижим.