Законы Гесса и Кирхгофа
Итак при (V,T) = const QV max = DU, а при (p,T) = const Qp max = DI. Тогда QV max и Qp max зависят только от начального и конечного состояний системы. Об этом и гласит закон Гесса: теплота реакции не зависит от пути реакции, а определяется лишь начальным и конечным состояниями реагирующих веществ.
Закон Гесса позволяет вычислить тепловые эффекты таких реакций, для которых они не могут быть непосредственно измерены.
Например, известно, что при полном сгорании углерода выделяется теплота 393700 кДж/моль:
C(т) + O2(г) = CO2(г) – 393700,
а при сгорании окиси углерода – 283300 кДж/моль:
CO(г) + 0,5O2(г) = CO2(г) – 283300.
Вычитая из первого уравнения второе, получим:
C(т) + 0,5O2(г) = CO(г) – 110400,
то есть при неполном сгорании углерода выделяется 110400 кДж/моль.
Характер температурной зависимости теплоты реакции определяется уравнением Кирхгофа:
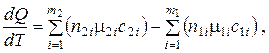
где  – числа молей и мольные теплоемкости исходных веществ;
– числа молей и мольные теплоемкости исходных веществ;
 – числа молей и мольные теплоемкости полученных веществ;
– числа молей и мольные теплоемкости полученных веществ;
m1 и m2 – число компонентов исходных и полученных в реакции веществ.
Таким образом, по закону Кирхгофа температурный коэффициент теплоты реакции равен разности сумм теплоемкостей, полученных в реакции, и исходных веществ.
Чтобы определить теплоту реакции при любой температуре, нужно знать зависимость Q(T).
Если принять
mс = mсo + aT + bT 2 + . . . ,
то есть в виде эмпирического степенного ряда, то теплота реакции может быть вычислена по формуле:
Q = Qo + aT + bT 2 + gT 3 + . . . ,
где


и т.д.