Стандартные состояния. Стандартные условия
В системах с химическими процессами основной причиной изменения термодинамических параметров являются химические реакции. Поскольку химические превращения весьма разнообразны возникает проблема выбора начала отсчета энергетических величин, например термодинамических потенциалов. С этой целью в термодинамике широко применяют такие понятия, как стандартные состояния и стандартные условия. Учитывая, что в химических реакциях элементы друг в друга не вращаются, в качестве нуля отсчета берут совокупность всех химических элементов в виде простых веществ, находящихся в более устойчивых формах при 25°С. Эта выбранная совокупность простых веществ образует базис для проведения термодинамических расчетов, а каждое простое вещество, входящее в базис, является базисным веществом. Для выполнения термодинамических расчетов используют параметры вещества в стандартном состоянии.
Стандартное состояние выбрано в соответствии с рекомендацией ИЮПАК следующим образом:
1) температура вещества в стандартном состоянии равна температуре системы: Т = Т(системы);
2) давление над веществом или давление газообразного вещества в стандартном состоянии (Р0) равно 1 бар:
Р= Р0 = 1 бар
(1 бар = 105 Па). (Паскали рекомендованы для использования ИЮПАК с 1982 г.) Ранее в качестве стандартного состояния использовалась одна атмосфера (1 атм = 101325 Па). Несмотря на то по различия в единицах невелики, рекомендуется обращать внимание на единицы измерения давления.
3) Для жидких и твердых веществ берут реальные состояния при P0 = 1 бар и температуре Т. (Иногда в рассмотрение вводят и вещества в гипотетических состояниях — например, воду в виде газ при давлении 1 бар при температуре ниже 100°С или в виде льда при 25 °С.)
Термодинамические величины, характеризующие вещества в стандартном состоянии, называют стандартными, а для их обозначения используют верхний индекс, например  .
.
В качестве  используют 298,15 К (25°С).
используют 298,15 К (25°С).
Под стандартной энтальпией 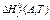 и энергией Гиббса
и энергией Гиббса  образования вещества А обычно понимают изменение энтальпии и энергии Гиббса в реакции:
образования вещества А обычно понимают изменение энтальпии и энергии Гиббса в реакции:
 , где
, где 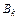 – базисные вещества.
– базисные вещества.
Индекс f происходит от английского слова formation. Он используется для обозначения реакции образования вещества из простых базисных веществ. Если вещества  и А находятся в стандартных условиях, то говорят о стандартной энтальпии, стандартной энтропии и стандартной энергии Гиббса образования при стандартных условиях:
и А находятся в стандартных условиях, то говорят о стандартной энтальпии, стандартной энтропии и стандартной энергии Гиббса образования при стандартных условиях:
 ,
, 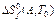 ,
, 
Для базисных веществ в любых стандартных состояниях принимают 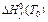 =0 кДж/моль и
=0 кДж/моль и  =0 кДж/моль. Обычно расчет термодинамических параметров при любых температурах основывается на использовании стандартных состояний при стандартных условиях, для которых также полагают
=0 кДж/моль. Обычно расчет термодинамических параметров при любых температурах основывается на использовании стандартных состояний при стандартных условиях, для которых также полагают 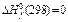 кДж/моль и
кДж/моль и  кДж/моль. В таблицах обычно приводятся значения стандартных энтальпий образования соединений из простых базисных веществ при стандартных условиях с обозначениями
кДж/моль. В таблицах обычно приводятся значения стандартных энтальпий образования соединений из простых базисных веществ при стандартных условиях с обозначениями  в расчете на один моль образованного вещества А.
в расчете на один моль образованного вещества А.