Спаренные электроны атома донора
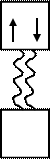
Свободная орбиталь атома акцептора
Атом, предоставляющий электронную пару, называется донором, а принимающий ее на свою свободную орбиталь - акцептором.
Примером возникновения ковалентной связи по донорно-акцепторному механизму является образование иона аммония из молекулы аммиака и иона водорода:
NH3 + H+ → NH4+.
В молекуле аммиака 3 неспаренных электрона атома азота образуют три валентных связи с тремя атомами водорода по обычному механизму образования ковалентной связи. Неподеленная электронная пара 2s атома азота (донор) заняла свободную орбиталь иона водорода (акцептор), образующегося при диссоциации молекулы кислоты, например, HCI.
2s 2p
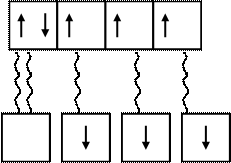 N
N
Донорно-акцепторный обычный механизм