Строение атома
Глава 4
Строение атома. Химическая связь.
Периодический закон Д.И.Менделеева.
В 1869 году Д.И. Менделеев формулирует открытый им периодический закон:
«свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
В настоящее время вместо понятия «атомный вес» используется понятие «атомная масса».
Дальнейшее развитие естествознания, особенно учения о строении атома, показало, что индивидуальность химического элемента
определяется зарядом его ядра, а химические свойства элементов и
их соединений, периодическая повторяемость их у разных элементов определяются строением электронной оболочки атома, которая, в свою очередь, зависит от заряда ядра атома.
Современная формулировка периодического закона Д.И. Менделеевагласит:
«Свойства химических элементов, а также свойства и форма образуемых ими соединений, находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов».
Таким образом, для того, чтобы понять причину периодичности
свойств соединений химических элементов, надо обратиться к изучению строения атома.
Строение атома
Атом – это наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
По современным представлениям атом - это электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
В свою очередь ядро атома состоит из протонов, нейтронов (общее название - нуклоны) и большого числа других частиц. Электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента.

Рис. 4.1. Схема строения атома элемента.
Протон  - положительно заряженная микрочастица с зарядом +1,6·10-19 К, условно принятым за единицу положительного заряда qр = +1. Масса протона близка к 1 а.е.м. Общее число протонов Np, входящих в состав ядра, определяет общий заряд ядра атома и его порядковый номер в Периодической системе элементов Д.И. Менделеева.
- положительно заряженная микрочастица с зарядом +1,6·10-19 К, условно принятым за единицу положительного заряда qр = +1. Масса протона близка к 1 а.е.м. Общее число протонов Np, входящих в состав ядра, определяет общий заряд ядра атома и его порядковый номер в Периодической системе элементов Д.И. Менделеева.
Нейтрон 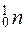 - электронейтральная микрочастица входящая в состав ядра атома. Его масса, как и масса протона, близка к 1 а.е.м.
- электронейтральная микрочастица входящая в состав ядра атома. Его масса, как и масса протона, близка к 1 а.е.м.
Нуклоны(от лат. nucleus – ядро, зерно, косточка) – собирательное название протонов и нейтронов – основных частиц, образующих атомные ядра.
Электрон ē - отрицательно заряженная микрочастица, входящая в состав атома и несущая наименьший электрический заряд -1,6×10-19 Кл. Для удобства величина этого «элементарного» заряда принята за единицу qe = -1. Так как атом в целом электронейтрален, то число электронов равно заряду ядра этого атома.
Например, заряд ядра атома натрия 11Na равен +11. Вокруг ядра размещается 11 электронов с общим отрицательным зарядом –11.
Основная масса атома (m) сосредоточена в его ядре, так как масса электронов мала и не вносит существенного вклада в массу всего атома. Масса электрона составляет лишь  от массы протона или нейтрона.
от массы протона или нейтрона.
Масса атома, таким образом, фактически складывается исходя из масс всех протонов (Np) и нейтронов (Nn) и характеризуется массовым числом (А).
Массовое число атома какого-либо элемента (А) численно равно сумме масс общего числа протонов (Np) и общего числа нейтронов (Nn):
A = Np + Nn.
Например, у атома калия  (порядковый номер в таблице Менделеева 19, массовое число равно 39) в ядре находится 19 протонов и 20 нейтронов, у атома бария
(порядковый номер в таблице Менделеева 19, массовое число равно 39) в ядре находится 19 протонов и 20 нейтронов, у атома бария  (порядковый номер 56, массовое число 137) в ядре 56 протонов и 71 нейтрон.
(порядковый номер 56, массовое число 137) в ядре 56 протонов и 71 нейтрон.